Ce billet écrit par des étudiantes et étudiants de Master 1 du Magistère Européen de Génétique est co-publié sur le site de nos collaborateurs pédagogiques – Papier-Mâché. Promotion 2023-2024
Écriture : Giulia Boriosi, Carla Gianella, Julia Roche-Dupuy, Louis Romain
Relecture scientifique : Équipe pédagogique : Sandra Claret et Alain Zider
Relecture de forme : Lucile Rey
Temps de lecture : environ 10 minutes.
Thématiques : Biologie cellulaire (Biologie)
Publication originale : Chen J., et al., An alternative mode of epithelial polarity in the Drosophila midgut. PLoS Biology, 2018. DOI : 10.1371/journal.pbio.3000041
Notre corps est un territoire aussi fascinant que complexe, composé d’ensembles de cellules qui assurent son bon fonctionnement. Aujourd’hui, nous vous invitons à entreprendre un voyage captivant sur les pas des chercheur·ses ayant étudié la formation des tissus épithéliaux, barrières de notre corps face aux agressions extérieures.
Préparatifs : découverte des épithéliums
Toute excursion exige préparation, et l’itinéraire doit être planifié minutieusement. La première chose à faire est de se renseigner sur l’environnement de l’excursion : qu’est-ce qu’un épithélium ?
Un épithélium, c’est comme un gardien de notre corps, formant un tissu protecteur contre les éléments de l’environnement extérieur. Il agit comme un douanier vigilant qui régule ce qui rentre et sort de nos organes et de notre organisme. Saviez-vous qu’il en existe plusieurs types ? Eh oui, parmi les tissus épithéliaux on trouve la peau, mais aussi les poumons, l’intestin, les reins ou même la surface de l’œil !
La peau, par exemple, forme une barrière très robuste et épaisse. Elle limite la pénétration d’UV provenant des rayons du soleil, évitant ainsi les coups de soleil qui produisent des dommages à l’ADN. Là où la peau joue le rôle de barrière difficilement pénétrable, la paroi intestinale contrôle les échanges de manière plus permissive. À l’image d’une douane chargée de maintenir les frontières, elle laisse les nutriments la traverser tout en empêchant les particules nuisibles de passer.
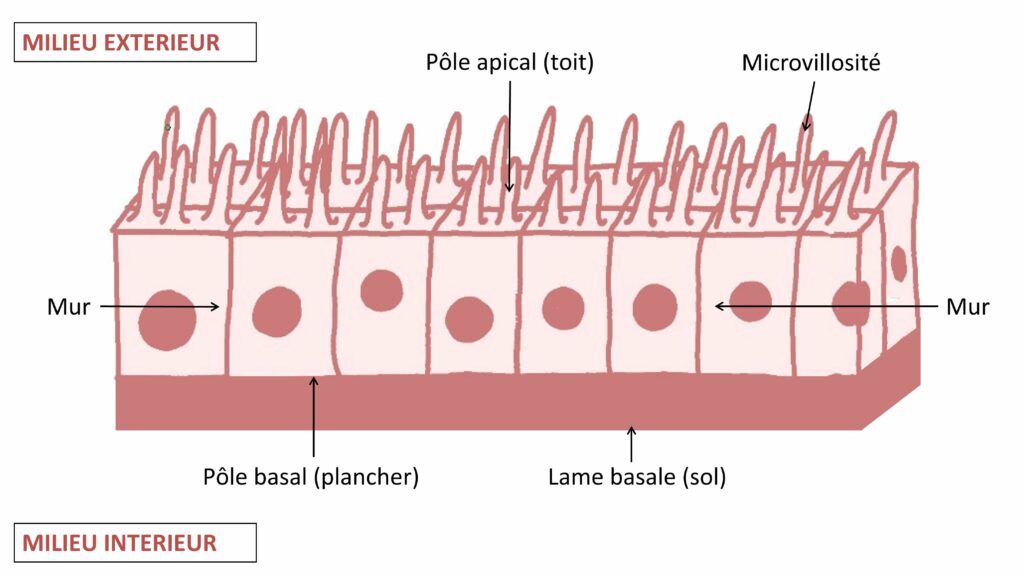
Pour exercer ce rôle de barrière, les épithéliums sont constitués de manière similaire : des cellules serrées les unes contre les autres formant un tissu étanche à toute tentative de pénétration non autorisée dans leur territoire. Pour se renseigner sur cet environnement, rien de mieux que le routard local de Buckley et St Johnston [1]. D’après ce guide, ces cellules, les cellules épithéliales, peuvent s’organiser en une couche unique, comme pour la paroi intestinale, ou en couches multiples, comme dans le cas de la peau. Au sein de ces tissus épithéliaux, chaque cellule est organisée de façon polarisé et précise, c’est-à-dire que la cellule a un sens, et que les éléments qui la forment et la composent diffèrent d’une extrémité à l’autre. Par exemple, les cellules d’un épithélium composé d’une seule couche possèdent deux pôles :
- le pôle apical : sorte de toit de la cellule, il est en contact avec l’environnement extérieur. Dans le cas d’une cellule de l’épithélium intestinal, cette surface d’échanges entre le milieu extérieur et le milieu intérieur est augmentée grâce à la présence de projections en doigt de gants appelés microvillosités (Figure 1).
- le pôle basal : sorte de plancher de la cellule. Il est en contact avec le milieu intérieur et est ancré sur une membrane appelée la lame basale. Ce pôle de la cellule a une fonction de soutien du tissu épithélial.
Les côtés latéraux de la cellule (les murs) forment des contacts étanches avec ceux des cellules voisines (Figure 1).
Cette organisation asymétrique des cellules épithéliales est essentielle pour assurer leur fonctionnement correct. Elle leur permet entre autres d’acquérir le rôle de douane, régulant ce qui entre et sort du corps.
Cette polarisation des cellules épithéliales si importante pour la survie semble commune à de nombreuses espèces, mais… est-ce vraiment le cas ? C’est la question qui a amené le Dr Chen et ses collègues, un groupe de scientifiques chevronnés, à partir explorer l’épithélium… de mouches ! Parés de nos connaissances épithéliales, nous sommes maintenant prêts à les accompagner.
Le grand départ : sur les pas des chercheur·ses
La constitution des épithéliums, marqueur de leur polarité, est très similaire au sein du monde vivant. Ainsi, et jusqu’à la parution de la publication du Dr. Chen et de ses collègues, l’hypothèse de l’existence d’un mécanisme universel de polarisation des cellules, un modèle de référence qui serait valide à la fois pour les drosophiles et les êtres humains, semblait la plus logique.
C’est dans les cellules épithéliales du squelette externe de la petite mouche des fruits Drosophila melanogaster qu’ont été découverts les mécanismes et les acteurs de la polarisation cellulaire. L’intérêt d’utiliser cette petite mouche est que ses cellules sont tout aussi complexes que les cellules épithéliales humaines, mais dans un organisme plus simple à étudier et à manipuler en laboratoire. Le fait que les drosophiles se reproduisent rapidement et ont une descendance nombreuse est également un atout, puisque cela rend possible l’étude d’un même phénomène sur beaucoup d’individus, en peu de temps, et d’observer la transmission de ce phénomène à leur descendance. Enfin, il existe de nombreux outils développés par les scientifiques dédiés à l’étude de la mouche, ce qui facilite la recherche sur les mécanismes génétiques et développementaux.
Le mécanisme découvert chez la drosophile impliquerait un ensemble de gènes codant différentes protéines canoniques, c’est-à-dire des protéines « modèles » bien connues, responsables de la mise en place des différentes régions d’une cellule épithéliale. Par exemple, les protéines Crumb (en anglais miette) et Bazooka déterminent respectivement le toit de la cellule et les adhésions de la cellule à ses voisines. Les multiples acteurs de la polarisation étant interdépendants, il suffit qu’un seul soit défectueux pour entraîner un démantèlement de la structure d’un épithélium et une perte de la fonction protectrice de cet épithélium. Un défaut d’expression des gènes codant les protéines Crumb et Bazooka provoquerait ainsi une diminution de leur quantité dans la cellule, et donc la perte du toit et des adhésions entre les cellules épithéliales de la « peau » de la drosophile. L’acteur le plus mémorable est sans doute le gène qui code la protéine Bazooka, dont le nom rend compte du désordre observé en son absence, comme nous allons le voir bientôt.
Partant de l’hypothèse que ce modèle de polarisation n’est pas conservé chez tous les organismes vivants, l’équipe du Dr Chen a décidé d’étudier un autre épithélium de la drosophile que celui du squelette externe. Et, surprise : en survolant l’épithélium de l’intestin moyen de la drosophile (Figure 2), l’équipe de recherche a rencontré quelques turbulences. Ces cellules présentent en effet quelques spécificités de polarisation.
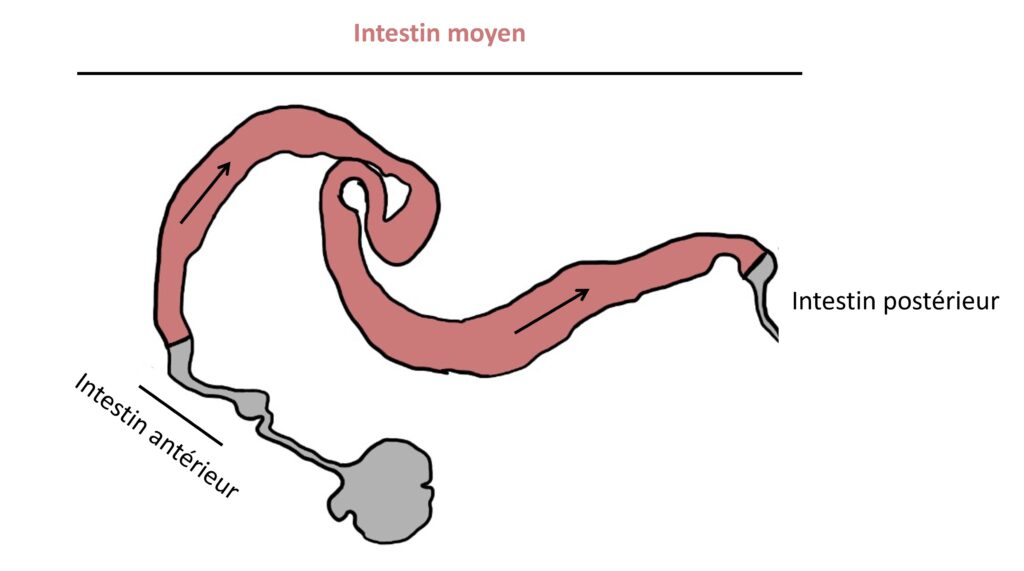
Pour comprendre l’origine de ces spécificités, les scientifiques se sont demandé quel serait l’effet de la suppression systématique des acteurs de polarité du modèle de référence dans ces cellules de l’intestin moyen. Pour cela, ils ont muté un à un le gène Bazooka, le gène Crumb et les gènes de construction des murs de ces cellules pour les rendre incapables d’initier la production de leurs protéines respectives. Afin de vérifier précisément l’effet des mutations sur la structure des cellules, ils se sont appuyés sur des méthodes de microscopie permettant de mettre en valeur certains éléments de leur cytosquelette. Le Dr. Chen et ses collègues s’attendaient alors à ce que chaque mutant perde son toit, ses murs et ses contacts aux cellules voisines, ou même qu’il y ait deux toits. Mais non ! Étonnamment, ces cellules ne présentent aucune anomalie notable de polarisation. Cela suggère donc que la polarisation des cellules épithéliales de l’intestin moyen de la drosophile implique d’autres facteurs, différents des protéines canoniques.
Changement de cap : un nouveau modèle ?
Suite à ces résultats surprenants, qui ont montré que les protéines que l’on pensait actrices majeures de la polarisation ne le sont en fait pas dans ce tissu, le Dr. Chen et ses collègues ont cherché à identifier les responsables de celle-ci. Suivons-les, changeons de direction à la recherche d’une autre piste d’atterrissage, un nouveau modèle en ces terres encore inconnues. Observons en détail les cellules épithéliales de l’intestin moyen de la drosophile : nous ne nous sommes pas encore intéressés à leur pôle basal. Serait-ce une piste possible ?
Au sein du pôle basal résident des protéines bien connues et présentes dans toutes les cellules épithéliales : les intégrines. Si nous comparons les cellules épithéliales à une maison, les protéines intégrines seraient les fondations qui ancrent les cellules dans la lame basale (Figure 3). Ces protéines sont des acteurs clés de la dynamique des cellules épithéliales, et régulent notamment leur adhérence au sol (lame basale) et entre elles. Pour caractériser l’importance de cette adhérence dans la mise en place d’une polarité cellulaire, le Dr Chen et son équipe ont créé des cellules n’exprimant plus les protéines intégrines. Ils ont ensuite visualisé ces cellules mutantes en utilisant une technique innovante : la technique MARCM. Cette technique repose sur la modification génétique de cellules pour obtenir au sein d’un même individu un mélange de cellules normales (sans couleur) et mutantes (apparaissant en vert sous le microscope). Pour en savoir plus sur cette technique, nous vous invitons à consulter les pages supplémentaires de notre guide de voyage [voir Pour approfondir].
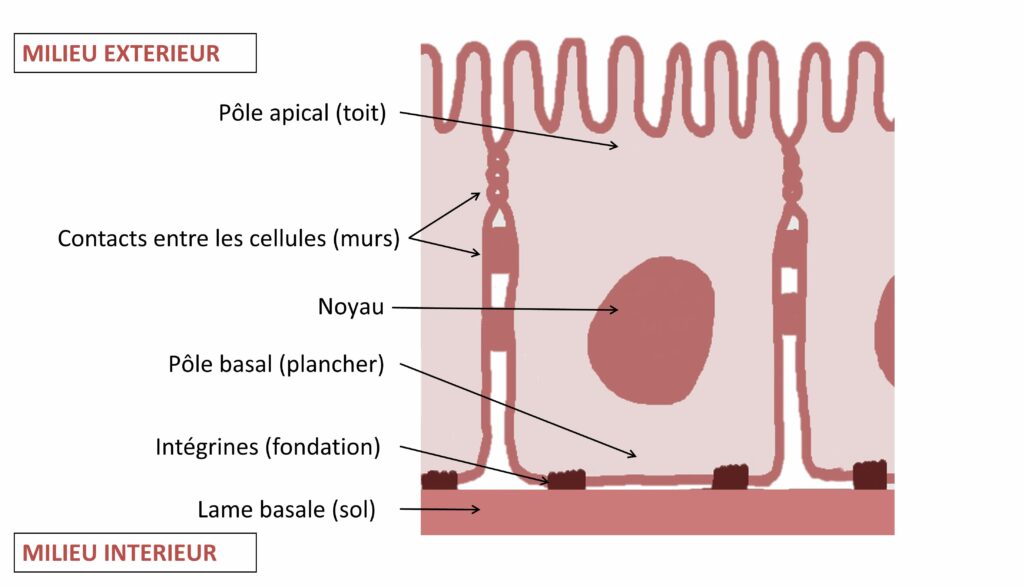
Jia Chen et ses collègues ont observé que l’absence d’intégrines entraîne un détachement de la cellule épithéliale de son socle et une incapacité de la cellule à se polariser. Ainsi, la mutation rend la barrière intestinale non fonctionnelle : sans fondations solides, il n’est pas possible de bâtir le reste de la maison !
Le mécanisme de polarisation des cellules épithéliales dans l’intestin moyen de la drosophile semble très similaire à celui des mammifères : sans intégrines fonctionnelles, la cellule épithéliale n’acquiert pas l’organisation présentée en Figure 3. Par exemple, des souris qui n’expriment pas PAR3 (équivalent de Bazooka chez les mammifères) montrent une formation normale de la plupart de leurs épithéliums [2]. Ainsi, à l’instar de ce qui est observé dans l’intestin moyen de la drosophile, les protéines canoniques ne sont pas indispensables chez les vertébrés.
Atterrissage : conclusion
Nous voilà arrivés à destination !
En somme, à travers ce voyage, nous avons découvert que la polarisation des cellules est nécessaire pour que le tissu épithélial soit une barrière structurellement et fonctionnellement efficace. Mais nous avons aussi observé l’incroyable complexité des épithéliums et des mécanismes qui permettent leur polarisation. Cette publication démontre que les mécanismes sous-jacents de polarisation ne sont pas partagés entre les différents types de tissus épithéliaux (peau, intestin ou autres), et entre les organismes vivants.
La mise en lumière d’un mécanisme de polarisation indépendant des gènes canoniques et mettant en jeu des protéines de la lame basale est une nouvelle piste d’explication et d’exploration du mécanisme à l’œuvre chez les vertébrés, et donc chez l’être humain. À terme, cela permettrait de mieux appréhender les maladies liées à une perte de polarisation cellulaire, comme c’est le cas pour les cancers.
Mais certaines questions restent encore en suspens : existe-t-il encore d’autres modèles de polarisation ? Ce nouveau modèle est-il réellement représentatif de ce qui se passe chez l’être humain ? Malheureusement, l’étude des tissus humains reste compliquée, notamment à cause des débats éthiques soulevés par de telles expérimentations, et de leur coût élevé. Cependant, dans un futur proche cela pourrait devenir possible grâce à d’autres supports d’études comme les cultures de cellules humaines… Mais cela est un autre voyage.
N’oublions pas : ce sont ces barrières qui nous permettent de voyager en toute sécurité dans cette aventure qu’est la vie !
Nous vous remercions d’avoir choisi notre compagnie et espérons que vous êtes satisfaits par nos prestations.
À bientôt pour de nouvelles aventures !
Éléments pour approfondir
Escale : pour approfondir – technique MARCM
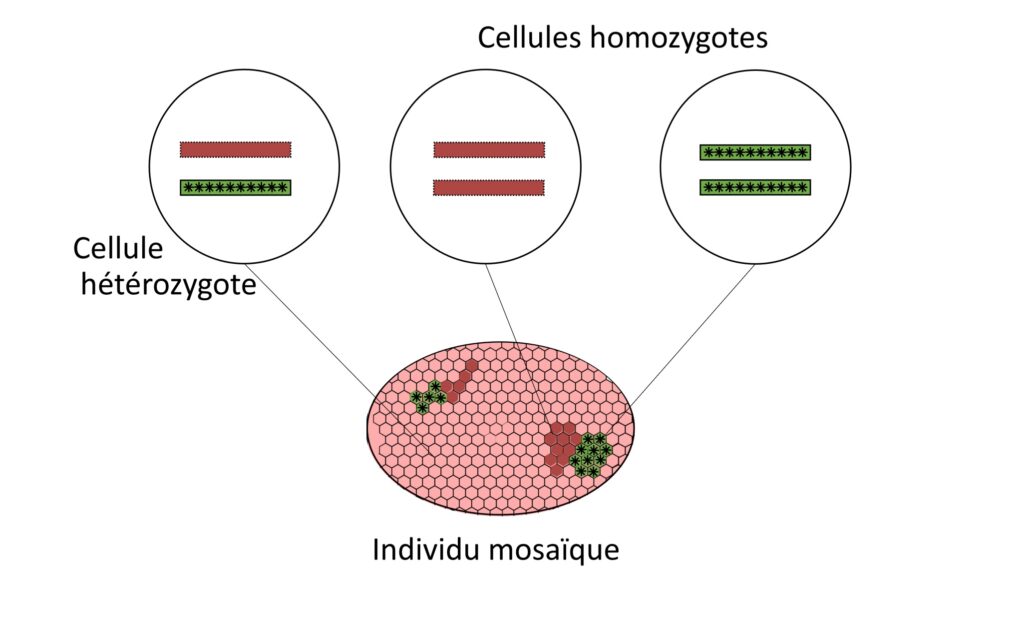
L’étude systématique d’organismes mutants n’est pas tout le temps possible car certaines mutations ne permettent pas la survie de l’organisme. C’est le cas de certaines mutations homozygotes s’exprimant dans l’organisme entier. Une cellule homozygote se définit comme une cellule qui possède deux versions identiques d’un même gène, par opposition à une cellule hétérozygote qui possède deux versions différentes.
Pour contrer cela, les scientifiques utilisent différentes stratégies, comme l’étude de l’effet de ces mutations dans des systèmes simplifiés (culture cellulaire, reconstitution de tissus etc.). Une autre approche consiste à induire ces mutations uniquement dans certains tissus (par exemple dans le tissu épithélial) ou à certains moments du cycle de vie d’un organisme, ce qui peut permettre leur observation directement in vivo, c’est-à-dire au sein même de l’organisme vivant. Cela est utile pour comparer à la fois le comportement des cellules mutantes et celui des cellules « normales » au sein d’un même organisme dit individu mosaïque (Figure 4).
Une fois que ces différents types de cellules ont été générés, le défi est de pouvoir les observer. Ici la Dr. Jia Chen et ses collègues ont opté pour ce type d’approche pour les gènes comme bazooka et crumb, en les étudiant par la technique de Mosaic Analysis with a Repressible Cell Marker (Analyse mosaïque utilisant un marqueur cellulaire répressif) ou MARCM. Cette technique vise à obtenir au sein d’un même individu initialement hétérozygote pour une mutation d’intérêt, une mosaïque de cellules sauvages et mutantes distinguables visuellement par leur expression ou non d’un gène rapporteur (ici une protéine fluorescente verte, la GFP) (Figure 5) [3].
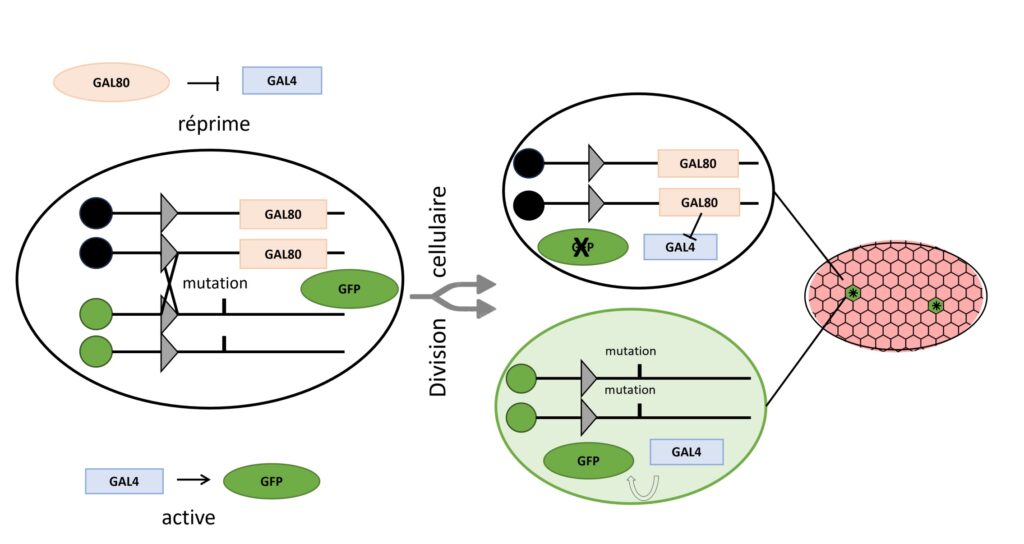
La première étape est de générer l’effet mosaïque, c’est-à-dire de générer les deux types de cellules homozygotes à partir d’un type de cellules hétérozygotes (la recombinaison). Pour cela, les scientifiques se servent de lignées de drosophiles qui possèdent un gène codant pour une recombinase. Son rôle, pour les scientifiques, est d’échanger deux morceaux de chromosomes qui possèdent des séquences d’ADN qu’elle est capable de reconnaître (Figure 5, les triangles gris) [*]. Après recombinaison et mitose, on obtient donc 3 types de cellules :
- des cellules homozygotes normales, qui possèdent le gène gal80 et produisent la protéine correspondante ;
- des cellules homozygotes pour la mutation qui ne produisent pas la protéine GAL80 ;
- des cellules hétérozygotes, encore épargnées par l’évènement de recombinaison.
La deuxième étape est de distinguer les cellules homozygotes, qui ne produisent pas GAL80, des autres cellules. Pour ce faire, toutes les mouches possèdent également un gène codant pour la GFP introduit sous le contrôle de la protéine GAL4. Ainsi, lorsque la protéine GAL4 est présente et active, la GFP est également produite, et les cellules fluorescent en vert. GAL4 étant inactivée en présence de GAL80, on se retrouve avec les 3 possibilités suivantes (Figure 5) :
- des cellules homozygotes normales et des cellules hétérozygotes, qui produisent GAL80. Chez ces cellules, GAL4 est inactivée par GAL80 et la GFP n’est pas produite ;
- des cellules homozygotes pour la mutation qui ne produisent pas GAL80. GAL4 n’est donc pas inactivée, et la GFP est produite. La cellule apparaît avec une fluorescence verte au microscope.
[*] Il est possible de restreindre cette recombinaison, et donc la technique MARCM, à des tissus ou à des moments spécifiques du développement en modulant l’expression de la recombinase.
[1] Buckley C.E. & St Johnston D., Apical–basal polarity and the control of epithelial form and function. Nature Reviews Molecular Cell Biology, 2022. DOI : 10.1038/s41580-022-00465-y. [Review]
[2] Hirose T., et al., PAR3 is essential for cyst-mediated epicardial development by establishing apical cortical domains. Development, 2006. DOI : 10.1242/dev.02294. [Publication scientifique]
[3] Ejsmont R.K. & Hassan B.A., The Little Fly that Could: Wizardry and Artistry of Drosophila Genomics. Genes, 2014. DOI : 10.3390/genes5020385. [Review]
[4] Beira J.V. & Paro R., The legacy of Drosophila imaginal discs. Chromosoma, 2016. DOI : 10.1007/s00412-016-0595-4. [Review]
