Mots clés : Billets de Blog, Bionum, MEG
Etiquettes: Cancer, Cellules souches, Déterminants cellulaires, Différenciation cellulaire, Division asymétrique, Drosophila melanogaster, Mitose, Neuroblaste, Tumeur
A l’image d’une mosaïque, nous ne sommes pas simplement constitués de carreaux unicolores. Enfin, dans notre cas, d’un seul type de cellules. Pas besoin de chercher beaucoup pour trouver en toi des cellules musculaires, des cellules osseuses et même des neurones (normalement). Une partie des cellules dites “différenciées”, proviennent d’un type de cellules particulières : les cellules souches. En effet, grâce à un type de division particulière, ces cellules peuvent s’auto-renouveler tout en fournissant des cellules qui pourront se spécialiser et remplir différentes fonctions dans notre organisme.
Pour essayer de comprendre tout ça, je me suis moi-même lancé dans quelques recherches dans des livres, et revues (et un peu sur Wikipédia, oui je l’avoue). Les travaux du Dr Jens Januschke ont rapidement attiré mon attention. Ce beau et ténébreux chercheur écossais travaille justement sur ce type de division et étudie les phénomènes pouvant mener à un dysfonctionnement de ce processus. Il s’intéresse notamment aux défauts de division asymétrique menant à la formation de tumeurs.
Symétrique ou asymétrique ? Telle est la question…
Afin de croître et de se maintenir, un organe aura besoin de multiplier son nombre de cellules. Pour faire cela, les cellules vont pratiquer la mitose. Mais Kézako Matthéo ?
C’est très simple, la mitose correspond en fait à la division cellulaire : une cellule “mère” va être capable de se séparer en deux pour produire deux cellules “filles”[1]. Si jamais tu as quelques doutes sur la mitose, ne t’inquiète pas : tu peux utiliser le site du CNRS comme anti-sèche.
Cellopolis : une ville à petite échelle
On va maintenant différencier deux types de divisions : symétrique et asymétrique.
Ce qu’il faut comprendre, c’est que la cellule est comme une ville (appelons là Cellopolis) [2], qui va avoir des habitants (les protéines) répartis entre les rues (le cytoplasme) et les différents bâtiments (les organites). Le noyau, par exemple, pourrait être considéré comme la mairie qui abrite en son coeur une grande bibliothèque contenant toutes les lois de la ville (l’ADN). De plus, chacune des protéines de la cellule va avoir un rôle spécifique à jouer là où elle se trouve. En somme c’est une ville parfaite où personne ne connaît le chômage et tout le monde travaille dans un même but : la survie de la cellule.

Schéma d’une cellule eucaryote (animale)
© Science Primer (National Center for Biotechnology Information)
Dans cette analogie, la division cellulaire est en fait la construction de deux villes identiques à partir d’une seule, ce qui va nécessiter beaucoup de main d’œuvre !
- Lors de la division symétrique, les ouvriers se partagent le travail équitablement dans les deux villes : il y aura le même nombre de protéines dans chacune d’elles, et les deux cellules auront donc la même taille (c’est ce qu’on a vu pour la mitose).
- Lors d’une division asymétrique, ce partage n’est plus équitable : certaines protéines du cytoplasme iront travailler et emménager préférentiellement dans une ville plutôt qu’une autre, et donc les deux cellules n’auront plus la même population ni la même taille [3]. Attention la différence a lieu uniquement au niveau du cytoplasme, le génome quant à lui reste identique entre les deux cellules filles : quelle que soit sa taille, une ville se doit d’avoir une mairie !
C’est donc cette différence dans la répartition des éléments cytoplasmiques qui distingue nos deux types de divisions. Voici un petit dessin qui peut servir de support visuel pour illustrer ces mécanismes :
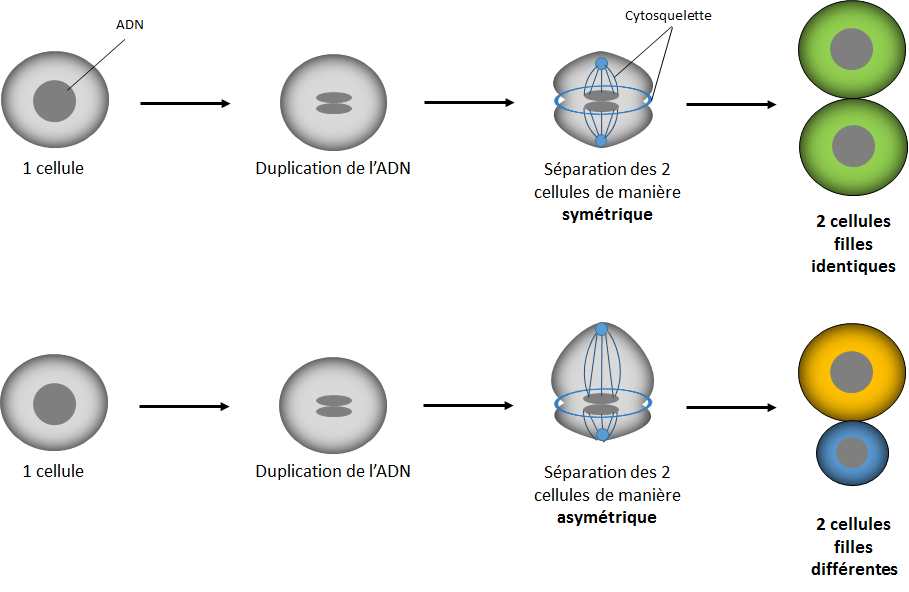
Modèle de division symétrique (en-haut) et asymétrique (en bas)
Cellule grise : cellule mère; Cellules vertes : cellules filles issues de la division symétrique; Cellules jaune et bleu : cellules filles issues de la division asymétrique
© Loubna Chaïr
Les cellules souches : des métropoles adeptes de la division asymétrique
Les divisions asymétriques ne peuvent pas être réalisées par n’importe quelles cellules ! Seulement quelques rares élues en sont capables : les cellules souches.
Tu l’as peut être compris, ces cellules sont un peu particulières. Si les cellules sont des villes, alors les cellules souches sont des métropoles. En effet, elles ont une importance cruciale pour la formation de notre organisme et son maintien. Elles ont la spécificité de pouvoir produire non seulement de nouvelles cellules souches qui leurs sont identiques (on parle d’auto-renouvellement), mais également des cellules spécialisées, qui acquerront leurs fonctions via un processus appelé “la différentiation”. Grâce à cela, lors du développement embryonnaire ces cellules permettent de générer toutes les autres cellules du corps. Et même à l’état adulte on peut encore en retrouver à différents endroits de notre organisme, qui permettent le renouvellement de certains tissus comme l’épiderme !
Ces mécanismes ont été mis en évidence par de nombreuses expériences réalisées sur des organismes modèles.
Mais qu’est ce que c’est ? Ce sont des êtres vivants sur lesquels on travaille afin d’étudier les mécanismes biologiques. Ils sont plus facilement manipulables que des humains, que ce soit physiquement, biologiquement (et accessoirement, c’est tout de même plus éthique). Jens Januschke, mon chercheur préféré, a choisi de travailler sur la drosophile.
Drosophila melanogaster : animal de compagnie favori des chercheurs depuis 1900

Photographie de Drosophila melanogaster,
©André Karwath aka Aka
La drosophile est une des stars des laboratoires de recherche. Il faut dire qu’elle est impressionnante avec ses yeux, ses pattes, ses ailes, ses magnifiques antennes… et on peut dire que certains prix Nobel lui doivent une fière chandelle ! [4]
Mais pourquoi cet insecte est-il aussi populaire ?
C’est son cycle de développement rapide, sa petite taille et les nombreuses techniques d’expérimentation disponibles qui le rendent si précieux. De plus son génome est totalement séquencé ce qui facilite les manipulations génétiques. On peut donc se servir de cette adorable petite mouche pour étudier comment un organisme entier peut être formé à partir d’une seule cellule. Et c’est en partie grâce à elle (et évidemment, grâce aux chercheurs travaillant dessus) que l’on a réussi à rassembler autant d’informations sur les cellules souches et la division asymétrique. Admet-le Matthieu, c’est l’insecte le plus sympa que tu connaisses !
Maintenant que je sais que tu ne regarderas plus jamais une mouche de la même manière, je vais t’expliquer le travail de nos chercheurs écossais !
Je te l’ai dis plus haut, le Dr Januschke se pose de nombreuses questions concernant la division cellulaire des cellules souches :
Quel mécanisme permet le bon déroulement de ce processus ? Comment un dysfonctionnement de la division asymétrique peut-il avoir des conséquences dramatiques sur l’organisme [5] ? Comment cela peut-il modifier les destins cellulaires (l’avenir des cellules) ? Et comment cela peut-il être à l’origine de tumeurs ?
C’est pour répondre à toutes ces questions existentielles que lui et son équipe de choc travaillent sur les cellules souches neurales de la drosophile : les neuroblastes. Ce sont ces cellules qui généreront par la suite les futures cellules du système nerveux (comme les neurones). Les neuroblastes sont hautement prolifératifs (ils font beaucoup de divisions, et surtout ces divisions sont asymétriques) et fournissent donc un système modèle bien caractérisé pour la division cellulaire asymétrique.
 Schéma d’un cerveau de larve de drosophile
Schéma d’un cerveau de larve de drosophile
CC: Cerveau Central, LO : Lobe Optique, CNV : Corde Nerveuse Ventrale
Ici, on peut observer une magnifique image en microscopie confocale de cerveau de notre merveilleuse drosophile à l’état larvaire (le bébé de la drosophile). Non, je sais très bien à quoi tu penses petit coquin, mais promis c’est bien une image de cerveau de drosophile. Les neuroblastes étudiés par Dr Januschke sont répartis dans le cerveau. Ils vont générer les futures cellules neuronales de ce cerveau. © gerit.linneweber
Au sein de ces neuroblastes, ils travaillent plus spécifiquement sur les déterminants d’identité cellulaire. Ces facteurs présents dans la cellule mère seront distribués exclusivement dans une seule des cellules filles et permettront sa différenciation.
Les déterminants d’identité cellulaire, une vraie galère !
Revenons tout d’abord à Cellopolis, notre petite utopie où le chômage n’existe pas. Dans cette ville, les déterminants d’identité cellulaire forment un petit groupe d’individus très particuliers : ce sont des architectes. En effet, ils sont capables de superviser les travaux des nouvelles villes (lors de la division), et de décider de leur devenir.
Plus particulièrement, pendant la division asymétrique, ces architectes vont tous se rendre au même endroit et organiser la construction d’une nouvelle ville, selon les plans qu’ils ont dessiné. Une fois construite, cette ville sera donc différente de l’originale.
De l’autre coté, sur le chantier de la deuxième ville, les ouvriers, privés d’architectes permettant d’innover, se contentent de recréer ce qu’ils connaissaient déjà. Ils construisent donc New Cellopolis, identique à la ville originale.
Après cette petite analogie on peut maintenant revenir au cas plus concret de nos cellules. L’héritage inégal de ces déterminants cellulaires est en fait une forme de communication qui a lieu entre les deux cellules filles. C’est comme ça que les cellules vont savoir laquelle va devenir quoi :
Ainsi, celle ayant reçu les déterminants va pouvoir se différencier et acquérir une identité, tandis que l’autre servira à renouveler la réserve de cellules souches.
Génial, n’est-ce-pas ?!
Il existe un grand nombre de déterminants d’identité cellulaire mais pour être plus clair, on va se limiter à un seul d’entre eux : la plus belle, la plus talentueuse, la magnifique .. .j’ai l’honneur de vous présenter la protéine *roulement de tambour*… Miranda !!
Dans un premier temps, au tout début de la division cellulaire, Miranda va être localisée à la périphérie de la cellule, tout du long de la membrane (en vert sur le schéma ci-dessous). Puis, Miranda va se regrouper au pôle basal de la cellule mère [6]. Ainsi au moment de la naissance de nos deux cellules filles, Miranda ne va se retrouver héritée que par l’une d’entre elles. Jusqu’ici pas de surprise Elise !
Mais son rôle ne s’arrête pas à là ! En effet, Miranda a la propriété d’induire l’expression de certains gènes particuliers. Grâce à cela, de nouvelles protéines seront produites dans la cellule ayant hérité Miranda et permettront de la différencier . Cette dernière pourra alors par exemple donner naissance à une cellule du système nerveux, dans le cas des neuroblastes. A l’inverse, la cellule fille qui n’a pas recueillie Miranda sera celle qui servira à l’auto-renouvellement des cellules souches. En somme Miranda va en quelque sorte être chargée de recruter des ouvriers spécialisés dans la différenciation.
Miranda est donc l’information indispensable qui décidera quelle cellule se différenciera et quelle cellule servira à l’auto-renouvellement.

Migration de Miranda au cours de la division asymétrique
© Loubna Chaïr
Rentrons maintenant un peu plus dans les détails. Accroche ta ceinture Arthur ! Pour permettre à Miranda de se localiser correctement au pôle basal de la cellule, il lui faut une extension moléculaire appelé “groupe phosphate”. Ce groupe phosphate est donné lors d’un évènement de phosphorylation par le mentor de Miranda : aPKC [7]. La phosphorylation, c’est comme une sorte d’interrupteur central qui donne le top départ de la migration de Miranda vers le pôle basal de la cellule. En effet, en enclenchant l’interrupteur, aPKC, se trouvant au pôle apical de la cellule, va offrir un groupement phosphate à Miranda qui va s’enfuir à l’opposé de aPKC.
En ajoutant la phosphorylation par aPKC au schéma précédent, tu obtiens donc :
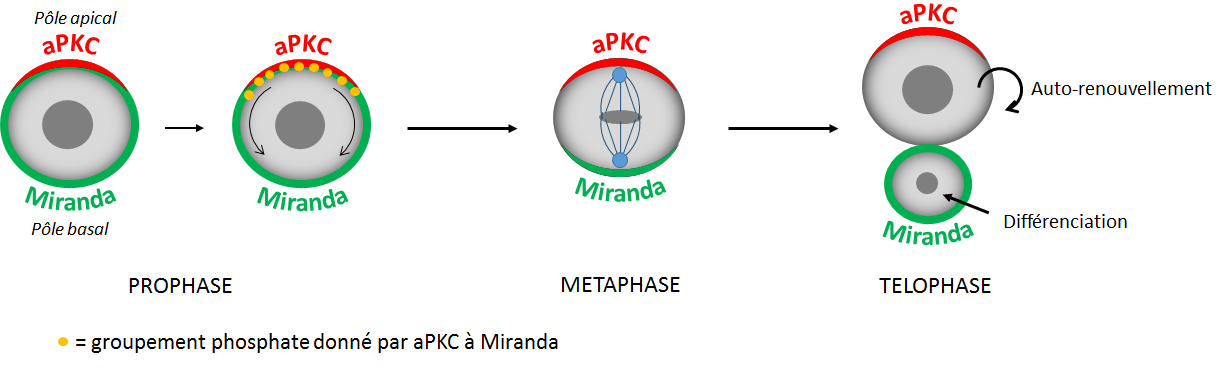
Migration de Miranda suite à sa phosphorylation par aPKC, au cours de la division asymétrique
© Loubna Chaïr
Des expériences ont d’ailleurs été réalisées afin que aPKC ne fonctionne plus dans les cellules [8]. Eh bien sans surprise, sans aPKC, c’est la catastrophe : Miranda ne se localise plus spécifiquement et suffisamment au pôle basal de la cellule. Elle ne peut donc plus donner de manière spécifique l’identité de “cellule à différencier” à une des cellules filles. Ainsi, sans aPKC, la répartition symétrique de Miranda cause un dysfonctionnement de la division asymétrique et peut même être à l’origine de la naissance de certaines tumeurs.

Effet de aPKC sur la migration de Miranda lors de la division
© Loubna Chaïr
Tu ne vois pas en quoi cela pourrait engendrer des tumeurs ? Pas de panique Patrick, je te l’explique !
Quand la symétrie s’emballe, le cancer se régale :
Si Miranda est perdue, tout est foutu!
Eh oui, on en arrive toujours au cancer. Ce grand méchant loup de la biologie qui fait trembler petits et grands… Et surtout les personnes qui cherchent leurs symptômes sur Doctissimo ! Même la drosophile, notre modèle préféré, ne peut pas y échapper. Surtout quand les chercheurs s’en mêlent…
En effet, j’en ai déjà parlé plus tôt : sans la division asymétrique la situation peut devenir catastrophique!! Imagine que d’un coup, il y ait un problème au niveau des cellules souches et qu’elles deviennent incapables de se diviser asymétriquement. Dans ce cas, les déterminants d’identité cellulaire sont répartis équitablement dans les deux cellules filles, et elles seront donc identiques à l’issue de la division. On rompt alors l’équilibre entre division asymétrique/division symétrique : on a trop de cellules qui vont s’auto-renouveler. Chacune d’elles pourront donner naissance à de nombreuses cellules spécialisées, ce qui a plus long terme, va entraîner la production d’un surplus de cellules spécialisées. Et un amas de cellules anarchiques qui prolifèrent sans contrôle, qu’est ce que ça peut donner ? Eh bien je te le donne dans le mille Emile : une tumeur !

Cellule souche normale VS Cellule souche tumorale
Voici un petit schéma simple qui met en opposition des cellules souches “normales” avec des cellules souches ne pouvant pas faire de division asymétrique. Attention à bien garder en tête qu’en temps normal les cellules souches sont aussi capables de faire de la division symétrique !
Afin d’en venir à l’étude de ce phénomène, laisse moi te parler des travaux d’un ancien collègue de Dr. Januschke : Cayetano Gonzalez.
Il y a quelques années (en 2005), le Dr. Gonzalez et son confrère Emmanuel Caussinus ont décidé d’étudier ce qui se passerait si la division asymétrique était altérée [9]. Pour ce faire ils ont réalisé une expérience tout à fait remarquable, qui est très souvent citée dans les travaux de notre cher Dr. Januschke : ils ont premièrement modifié chez des larves de drosophile l’ADN qui sert à produire Miranda afin qu’elle ne fonctionne plus, et qu’ainsi la division asymétrique ne puisse plus avoir lieu (puisque “Si Miranda est perdu, tout est foutu !” rappelle toi !). Ils ont ensuite transplanté le cerveau de ces larves dans l’abdomen de mouches adultes sauvages (c’est-à-dire, “normales”), afin d’étudier la prolifération des neuroblastes modifiés.
Si si, je te promets qu’ils ont vraiment fait ça!
Résultat : les parties du cerveau provenant des larves mutantes ont grossi beaucoup plus que la normale, certaines allant jusqu’à 100 fois leur taille d’origine ! En plus d’être d’une taille assez impressionnante, ces tumeurs ont aussi causé des dommages et même déplacé les organes de l’hôte au niveau de l’abdomen.

Expérience de Caussinus & Gonzalez, 2005
Sur ce schéma on peut voir les résultats de l’expérience décrite précédemment: à gauche un lobe de cerveau provenant d’un larve sauvage a été implanté dans une drosophile adulte. Les neuroblastes (marqués en vert grâce à une protéine fluorescente) n’ont pas proliféré et ne se sont pas éloignés du point d’implantation (flèche noire). La tâche noire au niveau du point d’implantation correspond à l’endroit de cicatrisation des greffes. A droite, un lobe de cerveau provenant d’une larve avec Miranda inactivée, a été implanté. Cette fois le tissu implanté a proliféré et a envahi l’abdomen de l’hôte. De plus il y a des petites tumeurs qui sont apparues (flèches jaune) à une grande distance du point d’implantation. Impressionnant non ?
Avec tout ça j’espère t’avoir convaincu qu’un dysfonctionnement dans le mécanisme de division asymétrique peut entraîner des tumeurs !
Cellules souches cancéreuses : au coeur des moeurs et des tumeurs
Mais pourquoi est-ce si intéressant d’étudier cela (à part le bonheur d’apprendre, mais ça, ça ne paye pas les factures)?
Eh bien chez les mammifères (dont nous faisons partie !), il existe un concept qui est très intéressant dans le cadre du travail de Jens Januschke : les cellules souches cancéreuses (CSC). [10] Les tumeurs proviendraient d’une petite population de cellules hautement prolifératives, capable de se régénérer et de produire des cellules tumorales en masse. Elles auraient donc des propriétés assez semblables aux cellules souches normales qui habitent nos tissus, à l’exception près qu’elles participent à un processus nocif pour notre organisme. Mais attention, l’origine de ces cellules souches cancéreuses est encore très mal comprise. Il est probable que ces cellules ne proviennent pas seulement de cellules souches normales, mais aussi de cellules tumorales qui auraient acquis des capacités très similaires à ces cellules souches par un mécanisme encore inconnu.
Bien sûr, rien n’indique qu’un dérèglement de la symétrie soit en cause dans chaque tumeur humaine. Mais les données obtenues par les Dr. Gonzalez et Caussinus, et par notre cher Dr. Januschke qui continue de travailler sur cette thématique, indiquent qu’il est fort possible qu’un défaut dans la division asymétrique soit en cause dans certains cancers [11]. Si tel était le cas, de nouvelles approches thérapeutiques pourraient être envisagées, en s’appuyant entre autres sur les travaux de Jens Januschke, qui contribuent à mieux comprendre tout ça !

Comparaison traitement conventionnel d’un cancer vs un traitement spécifique pour les cancers des cellules souches.
En vert une cellule souche cancéreuse et en orange des cellules cancéreuses
© inspiré d’un schéma de Peter Znamenskiy
En effet, le concept de cellules souches cancéreuses remet en question les traitements conventionnels utilisés contre certains types de cancer [12]. Jusqu’ici, ces thérapies visaient à éliminer les cellules cancéreuses dans leur globalité, sans essayer de détruire des cellules spécifiques à l’intérieur de la masse tumorale.
Cependant voilà où ça se complique : si en plus d’avoir des cellules cancéreuses “classiques”, une tumeur possède aussi des cellules souches cancéreuses, alors là notre traitement n’est plus très efficace ! On aura beau éliminer toutes les cellules cancéreuses que l’on veut, si les cellules souches restent indemnes, elles pourront de nouveau proliférer et de nouvelles tumeurs pourront se former. Le concept de cellules souches cancéreuses permet donc d’expliquer non seulement la croissance des tumeurs mais aussi la résistance à la chimiothérapie et même la récidive des cancers.
Tu pourrais me dire : Eh bien, c’est simple ! Il n’y a qu’à tuer ces cellules en particulier ! Mais pas si vite Brigitte : détecter ces cellules souches ce n’est pas si facile que ça ! Cela revient à chercher une aiguille dans une botte de foin, car on ne sait pas encore bien les identifier.
Et c’est à ce niveau que les travaux du Dr Januschke (eh oui, toujours lui !) sont utiles. En effet, ces recherches sur les cellules souches et leurs divisions pourraient aider à mieux caractériser les cellules souches cancéreuses afin de les cibler pour les éliminer.
Pour conclure, tu l’auras compris, c’est en étudiant les mécanismes régulant la division asymétrique que l’on sera capable de proposer des stratégies permettant d’en réduire les dysfonctionnements.
Ca y est, le billet touche à sa fin, bravo, tu as maintenant atteint le niveau ultime : la ceinture noire de la division asymétrique. Tu es maintenant un maître inégalable dans ce domaine (nan je plaisante, mais c’est déjà vraiment pas mal, Dr Januschke serait fier de toi). En espérant t’avoir convaincu, je te dis salut Manu !
Bibliographie :
Lectures scientifiques
[1] Jean-Claude Callen, (2005), Biologie Cellulaire : Des molécules aux organismes (2e édition)
[3] François Schweisguth, (1996). Ségrégation asymétrique de régulateurs de l’identité cellulaire lors de la mitose. Médecine/Sciences; 12 : 203-6 (Lien référence)
[4] A. Massaux, (2006). La Drosophile : un insecte au service de la science (Lien référence)
[6] Hannaford M, Ramat A, Loyer N and Januschke J, (2017). aPKC-mediated displacement and actomyosin-mediated retention asymmetrically localize Miranda in Drosophila neuroblasts. BioRxiv (Lien référence)
[7] Knoblich JA, (2010). Asymmetric cell division : recent developments and their implications for tumours biology. Nature Reviews Mol Cell Biol,11(12):849-60 (Lien référence)
[8] Melissa M. Rolls, Roger Albertson, Hsin-Pei Shih, Cheng-Yu Lee, et Chris Q. Doe, (2003). Drosophila aPKC regulates cell polarity and cell proliferation in neuroblasts and epithelia. J Cell Biol; 163(5): 1089–1098 (Lien référence)
[9] Caussinus E, Gonzalez C. (2005). Induction of tumor growth by altered stem-cell asymmetric division in Drosophila melanogaster. Nat Genet 37: 1125–1129. (Lien référence)
[10] Chartier & al. (2010). Mécanismes de division cellulaire asymétrique. Des organismes modèles au développement tumoral. Med Sci (Paris); 26 : 251–258 (Lien référence)
[11] Januschke J, Gonzalez C.(2008). Drosophila asymmetric division, polarity and cancer. Oncogene. 27(55):6994–7002. doi: 10.1038/onc.2008.349 (Lien référence)
[12] Felipe de Sousa E Melo, Louis Vermeulen, Jan Paul Medema, Idris Guessous (2011). Cellules souches cancéreuses et futures modalités thérapeutiques du cancer. Rev Med Suisse; volume 7. 774-777 (Lien référence)
Sites web
[5] Lien vers le laboratoire de Jens Januschke, Dundee
Vidéos
[2] Lien vers une vidéo YouTube “La cellule, une ville magnifique”



