Mots clés : Billets de Blog, Bionum, MEG
Etiquettes: Caenorhabditis elegans, cil, microvésicule, nématode, neurone
Vous pensez tout savoir à propos de vos cils ? Oui vous en avez autour des yeux mais ce n’est pas tout! Il en existe d’autre types… Ce ne sont pas des poils comme ceux présents autour des yeux, mais des structures cellulaires que nous ne pouvons pas voir à l’oeil nu. Ils sont situés à l’intérieur de notre corps, sur nos cellules (que l’on appelle donc cellules ciliées). Et ce n’est pas tout : Saviez-vous que pour communiquer entre elles, les cellules ciliées s’envoient des microvésicules, des sortes de petits sacs remplis de différentes molécules? Étonnant, n’est ce pas ?
Il y a dans notre corps 100 000 millions de cellules et chacune d’elles connaît exactement sa position et sa fonction. Comment cela est-il possible ? Eh bien c’est en partie grâce à la communication cellulaire. Les cellules communiquent entre elles, s’envoient des signaux qui correspondent à des informations. Alors oui, là nous parlons de l’Humain mais en réalité cela se passe comme ça dans toutes les espèces vivantes. Il existe plusieurs types de communication dont une très mystérieuse et intrigante… A l’origine de cette communication : les cellules ciliées.
Quand nos cellules se font des passes…
Commençons par une petite définition : Un cil, kézako ?
Un cil, en biologie, est une déformation et une extension de la membrane des cellules. La membrane cellulaire est formée par deux couches de lipides (du gras donc), et permet de protéger la cellule du milieu extérieur. Vous comprenez bien que ce gras là est plutôt indispensable et qu’il vaut mieux ne pas le perdre, même pour être beau l’été sur la plage : le gras c’est la vie ! Les cils sont observables chez la plupart des eucaryotes (organismes dont l’ADN est contenu dans le noyau des cellules, comme chez l’humain) sous deux formes : motiles1 et non-motiles1. Les motiles1 permettent la locomotion, mais ils ne nous intéressent pas ici. Les cils non-motiles1, aussi appelés cils primaires, permettent de sentir l’environnement physique et chimique de la cellule7. Ce sont eux qui produisent des microvésicules2. Mais à quoi ressemble ce cil responsable de cette intrigante communication entre les cellules?
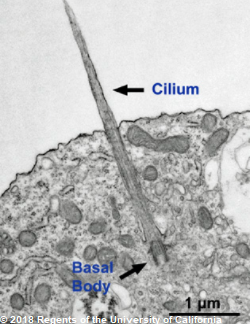
Figure 1 : Photographie d’un cil non-motile (ou primaire) d’un neurone. Cilium = cil, Basal body = corps basal.
Il est composé de deux parties distinctes8 :
- L’extrémité est composée de protéines qui permettent de former une structure rigide (axonème) donnant toute sa prestance au cil.
- Le corps basal, une zone un peu élargie à la base du cil dans laquelle l’axonème s’ancre.
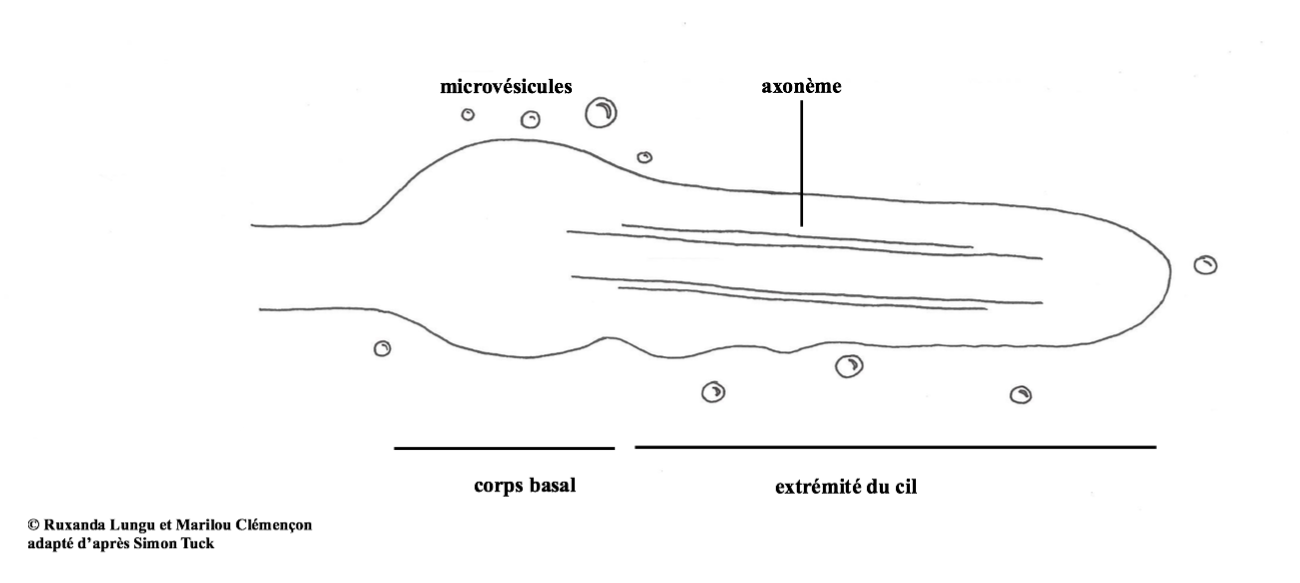
Figure 2: Structure d’un cil non-motile (ou primaire).
Les membranes de ces microvésicules sont composées d’un grand nombre de protéines et de lipides (il en existe plusieurs types, aux noms plus barbares les uns que les autres tels que les “fameux” phosphatidylsérines, phosphatidyléthanolamines, ou encore les sphingophospholipides). Ces microvésicules vont véhiculer des informations en transmettant différentes molécules, telles que des lipides ou des protéines, à d’autres cellules qui se situent plus ou moins loin. Les cellules qui reçoivent ces informations vont les interpréter et y répondre en changeant par exemple leur activité métabolique. Mauvaises microvésicules, mauvaise communication2 !
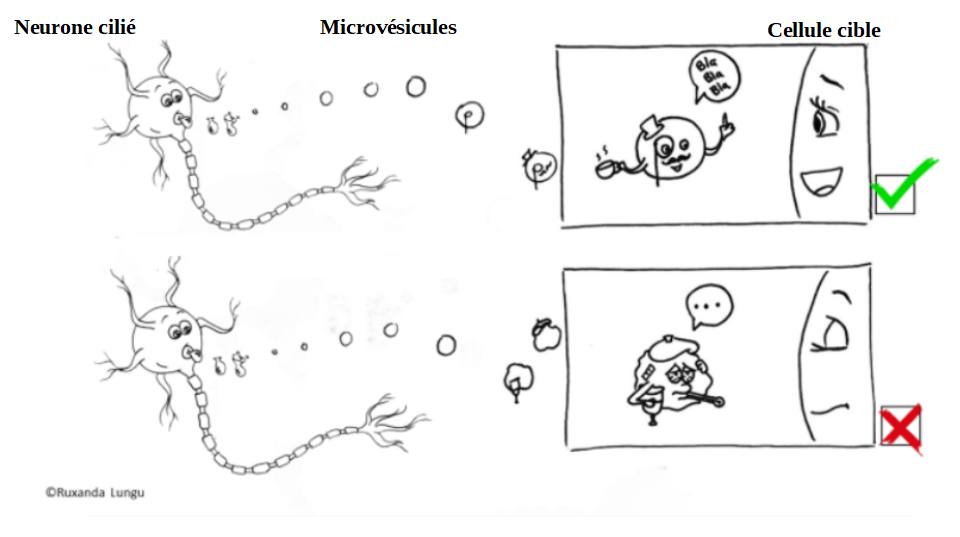
Figure 3 : Haut: Neurone cilié produisant des microvésicules saines, capables de transmettre un message aux cellules voisines. Bas: Neurone cilié produisant des microvésicules anormales, qui ne permettent pas de transmettre de message aux cellules voisines.
Si le lien entre les cellules ciliées et les microvésicules est aujourd’hui bien établi, le mécanisme par lequel ces microvésicules bourgeonnent des cils n’est pas encore connu. Pourquoi ne pas partir à sa recherche ?
Un petit ver à la conquête des microvésicules !
Un des animaux les plus utilisés pour l’étude des cils et des microvésicules est un petit ver qui répond au doux nom de Caenorhabditis elegans (C. elegans pour les intimes). Son étude a déjà permis d’apprendre beaucoup de choses sur le fonctionnement des cils et la communication entre cellules2.
Figure 4 : Photographie d’un ver C. elegans hermaphrodite.
Ce ver, fréquemment utilisé en laboratoire, est ce que nous appelons un «organisme modèle»9. Sur certains points, il ressemble beaucoup à d’autres organismes et apparaît donc comme un bon substitut. Nous pouvons comprendre comment certains mécanismes fonctionnent chez l’Homme, simplement en étudiant ce ver. Il facilite énormément le travail des chercheurs !
Évidemment, C. elegans n’est pas le seul organisme modèle qui existe. Il y en a des dizaines comme la souris ou le poisson-zèbre, et chacun a ses avantages et ses inconvénients. Mais pour comprendre le fonctionnement des cils notre petit ver est très approprié.
D’abord, il est transparent et autant dire que c’est bien pratique : un petit microscope et hop! les structures internes du ver sont observables. Nous pouvons entre autre voir ses neurones, ce qui est notre premier objectif.
Il est facile à élever et à stocker, car oui 1 millimètre ça ne prend pas beaucoup de place alors on peut en avoir plein. La grande gastronomie ce n’est pas trop son truc, il se nourrit simplement de bactéries.
Il a un cycle de vie EXTRÊMEMENT court ! Seulement 3 jours suffisent pour passer de la larve à l’adulte lorsqu’il se trouve à 25°C.
Chez cette espèce il existe une petite particularité… Il y a des mâles (jusqu’ici tout est classique) mais il n’y a pas de femelle ! Comment peuvent-ils se reproduire nous direz-vous? Les mâles se reproduisent entre eux? Eh non, il existe aussi des hermaphrodites.
Ces hermaphrodites peuvent s’autoféconder10 rapidement car ils possèdent les organes nécessaires pour la formation des ovules et des spermatozoïdes (oui ils se reproduisent avec… eux-mêmes!) alors que le mâle devra chercher un hermaphrodite et s’accoupler avec pour obtenir une descendance. Quelle perte de temps !
Une petite sextape de C. elegans, ça vous dit?6
C’est bien beau toute cette histoire de reproduction, mais vous vous demandez quel est le lien avec les microvésicules, n’est-ce pas?
Le mâle C. elegans produit des microvésicules dans sa queue, au niveau de neurones ciliés, et une mauvaise production induit des problèmes dans le comportement reproducteur2,5,6. Le mâle ne tourne plus autour de l’hermaphrodite, allant même jusqu’à ne plus s’en préoccuper du tout ! Nous pouvons donc savoir si les microvésicules sont anormales simplement en regardant ces vers se reproduire…pratique non?
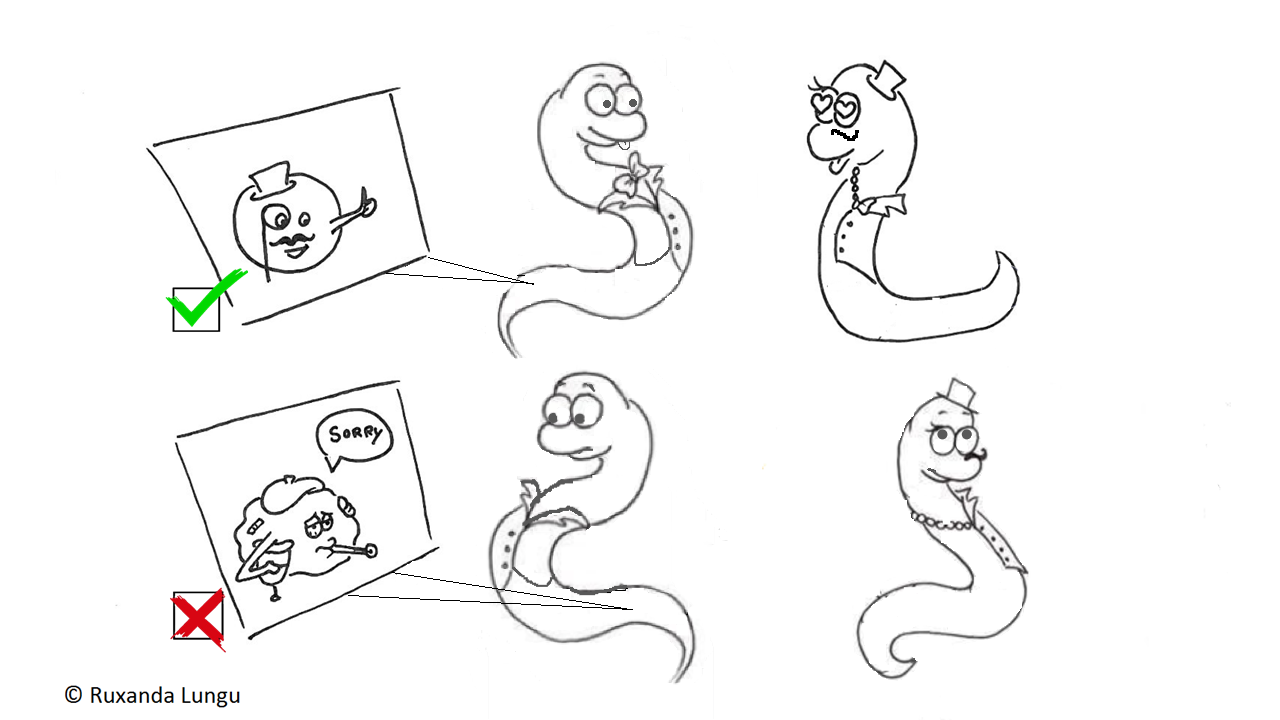
Figure 5 : Haut: Mâle produisant des microvésicules normales, qui lui permettent d’avoir un comportement reproducteur normal avec des vers hermaphrodites. Bas: Mâle produisant des microvésicules défectueuses qui affectent son comportement reproducteur : le mâle ne se préoccupe plus de l’hermaphrodite.
L’utilisation de C. elegans pour comprendre la formation des microvésicules n’en est qu’à ses débuts, mais ces dernières années des chercheurs ont trouvé des choses plutôt intéressantes. Récemment, l’équipe suédoise de Simon Tuck a décidé de se pencher plus spécifiquement sur ce mécanisme après avoir identifié des protéines qui permettent la formation de microvésicules3.
Mais comment attaquer les recherches sur cette mystérieuse communication avec des techniques simples ?
Tout d’abord, des mutants11 ! Ne vous méprenez pas ils ne vont pas se transformer, devenir grands, forts et verts comme Hulk. Ils ont seulement subi une modification dans les gènes suspectés d’avoir un rôle dans la formation des microvésicules.
C. elegans a cet avantage d’être hermaphrodite et de pouvoir s’autoféconder10 : très utile pour maintenir une mutation sans accouplement !
Si elle est à l’état homozygote, ou plus simplement si l’hermaphrodite possède deux copies identiques du gène, tous les descendants seront identiques au parent. Les “vers enfants” ont la même mutation que le “ver parent”. Nous avons alors une population de vers ayant une même mutation. Cette mutation peut causer des défauts dans la formation des microvésicules, ou dans leur mécanisme d’envoi à d’autres cellules par exemple.
Nous pouvons tout de même avoir ces descendants homozygotes en faisant des croisements entre un mâle et un hermaphrodite… mais c’est plus compliqué !
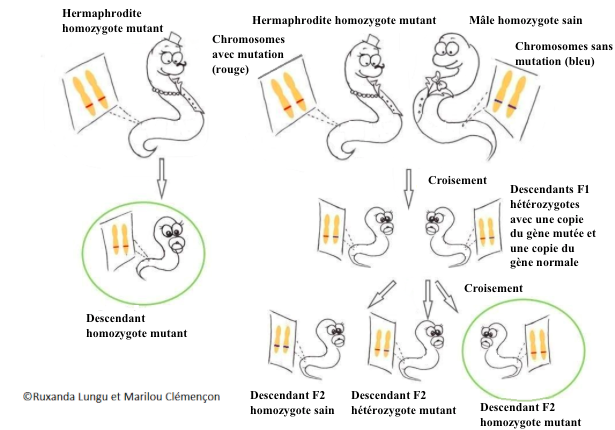
Figure 6 : Gauche: L’autofécondation d’un hermaphrodite homozygote pour une mutation donne 100% de descendants qui ont gardé la même mutation. Droite: A partir d’un croisement entre un mâle et un hermaphrodite homozygotes pour une mutation, il faut 3 générations pour avoir un descendant identique au parent muté. De plus, la proportion de ce type de descendants est seulement de 25%.
Nous avons nos mutants, mais on en fait quoi?
Il nous faut trouver d’autres angles d’attaque ! Pourquoi ne pas envisager d’utiliser des microscopes à très fort grossissement sur ces mutants pour directement aller à la source : la visualisation des membranes des neurones ? Tout ce processus se fait à une échelle minuscule, seulement quelques micromètres pour les microvésicules et quelques nanomètres pour les membranes ! Respectivement 1 000 fois et 1 000 000 de fois plus petites qu’une tête d’épingle !
Nous ne vous le rappellerons jamais assez, nos membranes sont un assemblage de plusieurs types de lipides, alors pourquoi ne pas imaginer que cette composition va avoir une influence sur l’activité de la cellule? Qu’il existe une composition en lipide particulière là où vont se former les microvésicules? C’est ce que Simon Tuck et son équipe ont démontré. Dans l’intestin par exemple il faut une majorité de phosphatidylsérines pour former des microvésicules3.
Vous nous direz, l’intestin, les neurones… aucun rapport ! Mais hop, un marquage des protéines liées à nos lipides dans les neurones ciliés pour les identifier, une observation au microscope, et le tour est joué ! On connait la composition des membranes formant nos microvésicules (d’accord, dans la réalité c’est un petit peu plus compliqué on vous l’accorde… mais l’idée est là)!
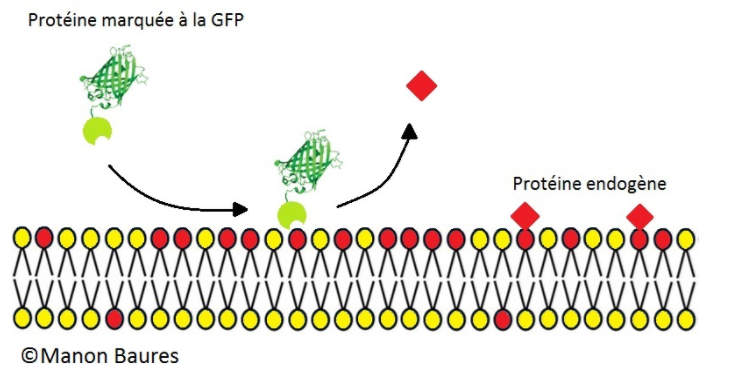
Figure 7 : Marquage des lipides membranaires Les protéines initialement fixées à notre lipide d’intérêt (endogènes) sont remplacées par des protéines accrochées à de la GFP qui permettront d’obtenir de la fluorescence verte une fois sous microscope à l’endroit où sont localisées ces protéines.
MICROvésicules mais GRAND enjeu…
La communication par des microvésicules, toutes les espèces l’utilisent, et en tant qu’humain on n’y échappe pas! Des vers, des maladies humaines… Vous ne voyez pas le rapport ? Nous avons des cils ET des microvésicules, et un défaut à ce niveau là peut causer des maladies répondant au nom barbare de “ciliopathies”1,4 ! Alors contrairement à C. elegans, ces cils sont partout dans notre corps, pas seulement sur nos neurones. La rétinite pigmentaire au niveau de l’oeil, la polykystose rénale (comme son nom l’indique, au niveau du rein), la dyskinésie ciliaire primitive touchant les poumons et les oreilles et de nombreuses autres : vous l’aurez compris, l’éventail de maladies impliquant ces cils est très large ! Plus de 20 types de ciliopathies existent, et le nombre de personnes atteintes est estimé à 1/1 000 4.
Et les symptômes causés n’ont pas à rougir devant cette variété avec notamment : obésité, surdité, infections respiratoires et infertilité (tout comme nos vers présentent des problèmes de reproduction).
Les recherches qui débutent sur C. elegans offrent donc de nouvelles perspectives pour comprendre comment fonctionnent les cils et microvésicules. Ceci mènera, on l’espère, à des pistes pour traiter ces maladies… qui ne tiennent qu’à un cil !
Bibliographie :
→ Article scientifique :
1) Mitchison, Hannah M., et Enza Maria Valente. « Motile and Non-Motile Cilia in Human Pathology: From Function to Phenotypes ». The Journal of Pathology 241, no 2 (janvier 2017): 294‑309. https://doi.org/10.1002/path.4843.
2) Wang, Juan, Malan Silva, Leonard A. Haas, Natalia S. Morsci, Ken C. Q. Nguyen, David H. Hall, et Maureen M. Barr. « C. Elegans Ciliated Sensory Neurons Release Extracellular Vesicles That Function in Animal Communication ». Current Biology: CB 24, no 5 (3 mars 2014): 519‑25. https://doi.org/10.1016/j.cub.2014.01.002.
3) Ruaud, Anne-Françoise, Lars Nilsson, Fabrice Richard, Morten Krog Larsen, Jean-Louis Bessereau, et Simon Tuck. « The C. Elegans P4-ATPase TAT-1 Regulates Lysosome Biogenesis and Endocytosis ». Traffic 10, no 1 (1 janvier 2009): 88‑100. https://doi.org/10.1111/j.1600-0854.2008.00844.x.
4) Tobin, Jonathan L., et Philip L. Beales. « The Non-motile Ciliopathies ». Genetics in Medicine 11, no 6 (juin 2009): 386‑402. https://doi.org/10.1097/GIM.0b013e3181a02882.
→ Site spécialisé C. elegans :
5) Bargmann, Cornelia I. Chemosensation in C. elegans. WormBook, 2006. https://www.ncbi.nlm.nih.gov/books/NBK19746/.
6) Barr, Maureen. « Male mating behavior ». WormBook, 2006. https://doi.org/10.1895/wormbook.1.78.1.
→ Blog scientifique :
7) « La double vie d’un cil ». Pourlascience.fr. Consulté le 13 février 2018. https://www.pourlascience.fr/sd/biologie-cellulaire/la-double-vie-dun-cil-10318.php.
8) « Comment se forme un cil cellulaire ? » Pourlascience.fr. Consulté le 13 février 2018. https://www.pourlascience.fr/sd/biologie-cellulaire/comment-se-forme-un-cil-cellulairenbsp-10736.php.
9) « Organismes modèles et au-delà… ». Consulté le 14 février 2018. http://tomroud.blogspot.fr/2007/02/au-del-des-organismes-modles.html
10) « biosex: C. elegans ». Consulté le 13 février 2018. http://biosex.univ-paris1.fr/le-zoo/c-elegans/.
→ Vidéo :
11) « Un mutant, c’est quoi ? ». Consulté le 15 février 2018. http://www.agroparistech.fr/podcast/Un-mutant-c-est-quoi.html
