Mots clés : Bionum, MEG
Etiquettes: ADN, cellules cibles, clonage, DMD, duchenne, dystrophine, hydrodynamique, maladies rares, myopathie, technologies émergentes, téléthon, thérapie génique, vecteur synthétique

En 1858, le Dr. Duchenne décrit une maladie caractérisée par une faiblesse musculaire progressive. Imaginez si on lui avait dit que l’on mettrait au point des navettes pour livrer de l’ADN sain au cœur des muscles malades pour soigner cette maladie… On serait bien passé pour des arriérés bons pour le bûcher. Comprenons le : quel charabia pour l’époque ! Pardon ?! Vous n’avez jamais entendu parler de ces navettes d’ADN ?! Une mise à jour s’impose. N’attendez plus : en route pour un voyage intracorporel inédit!
Petit préambule

Saviez-vous que l’insuline humaine, quotidiennement administrée à certains patients diabétiques, est produite industriellement par des bactéries? Une fois qu’on a transmis le fragment d’ADN contenant l’information nécessaire, elles s’occupent de synthétiser cette hormone comme si c’était la leur! La manipulation génique, est une des plus grande prouesse du 20e siècle. Cependant, pour de nombreuses maladies telle que la myopathie de Duchenne, on ne peut pas simplement administrer le produit correct pour remplacer celui qui fait défaut comme dans le cas de certains diabètes.
Il est nécessaire que le produit soit synthétisé par le corps humain lui-même. Il faut alors apporter directement les molécules d’ADN saines dans les cellules du patient : c’est la thérapie génique.
Avec 150 à 200 garçons nouveaux nés atteints chaque année en France, la myopathie de Duchenne est une maladie rare avec des conséquences dramatiques. Elle se caractérise par une dégradation progressive des muscles, se manifestant initialement par des faiblesses musculaires dans les membres inférieurs puis les symptômes s’étendent à tous les muscles. Oui, tout type de muscles : ceux pour pour les mouvements, ceux pour respirer y compris les muscles du cœur et du tube digestif…
Les scientifiques recherchent activement des solutions thérapeutiques mais actuellement aucun traitement n’existe pour guérir la maladie. La prise en charge des patients repose sur une amélioration de la qualité de vie des malades en cherchant à optimiser leurs capacités musculaires.
Avant de comprendre comment fonctionnent les thérapies actuelles pour lutter contre cette maladie, faisons une mise au point sur l’origine du problème.
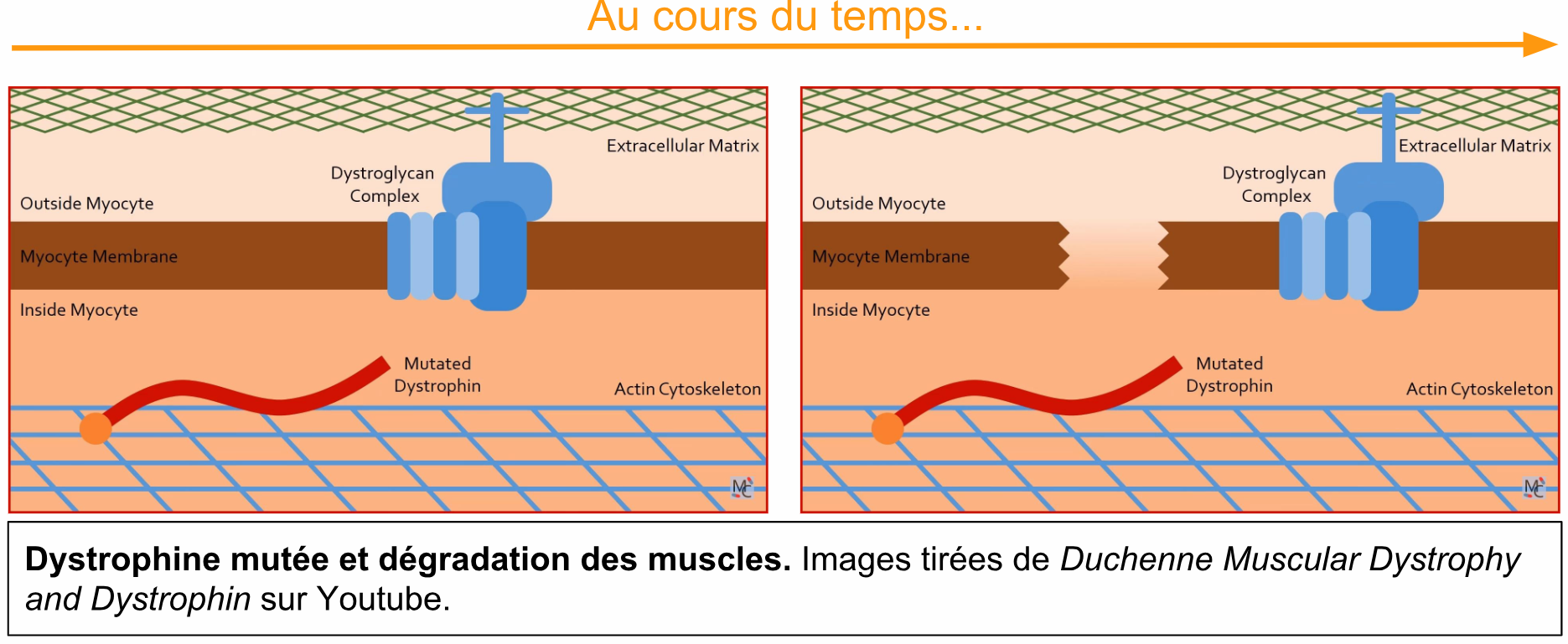
La myopathie de Duchenne est une maladie monogénique : elle est causée par une mutation présente sur un unique gène. Ce gène c’est DMD et il est responsable de la production d’une protéine appelée la dystrophine.

Localisation et action de la dystrophine lors d’une contraction musculaire
Image tirée de Duchenne Muscular Dystrophy and Dystrophin sur YouTube
Cette très grosse protéine est normalement localisée sous la membrane des cellules musculaires et fait le lien entre un complexe protéique appelé DAPC ((Dystrophin Associated Protein Complex) et le squelette de la cellule, le réseau d’actine. La dystrophine est indispensable au maintien de l’intégrité de la cellule. En effet, cette bodybuilder hors-paire joue le rôle d’amortisseur : elle absorbe les tensions crées par les contractions musculaires.
Maintenant, arrêtons nous une seconde et imaginons que cette protéine soit anormale, ou pire, absente. Vous voyez le soucis ? Plus d’amortisseur, plus d’absorption des tensions et la force générée par les contractions musculaires dégradent petit à petit les cellules des muscles.
Je vous vois venir, vous allez me dire que ce n’est pas trop grave puisqu’il y a les cellules souches qui peuvent former des cellules musculaires toutes neuves! Oui mais, c’est comme pour votre paquet de m&m’s, au bout d’un moment, il y a rupture de stock.
C’est pour ça que depuis des années, de nombreuses équipes de médecins, chercheurs, généticiens s’investissent avec opiniâtreté dans leur recherche pour trouver des solutions thérapeutiques (Chamberlain et all. 2017). La stratégie qui semble la plus efficace pour lutter contre la myopathie de Duchenne, c’est la thérapie génique : ce qui veut dire, apporter le gène « sain » directement dans les cellules musculaires pour remplacer le gène « malade ».
Vous trouvez ça ambitieux ? Vous avez bien raison. Le gène en question, DMD, est l’un des plus grand du génome humain. Vous imaginez vous cet long énergumène circuler dans les vaisseaux sanguins jusqu’aux cellules sans se faire dégrader? Difficilement! La circulation sanguine n’est pas un long fleuve tranquille, de grosses protéines rodent dans les parages … les nucléases!
Heureusement, les généticiens ont plus d’un tour dans leur sac ! Ils ont chercher à expédier l’ADN réparateur dans des capsules protectrices autrement appelées vecteurs. Et oui, comme votre dernière paire de basket commandé sur le net : arrivée chez vous dans un colis, c’est mieux !
Pour concevoir ces capsules protectrices, les généticiens ont d’abord pris exemple sur notre chère Dame Nature. En effet, les virus sont naturellement constitués d’une capsule, appelée capside, qui protège son petit ADN. Dans les premières expériences de thérapie génique sur l’homme, les scientifiques ont donc utilisé ces capsules protectrices en remplaçant l’ADN du virus par l’ADN réparateur qui sera donc protégé lors de son trajet dans le sang. Et cerise sur le gâteau, une fois dans les cellules, ces virus modifiés peuvent se multiplier et se propager dans l’organisme, permettant d’apporter en masse l’ADN réparateur aux cellules malades! Ce fut une prouesse dans le monde médicale. Pourtant, tout ne se passa pas comme prévu, cette stratégie avait un inconvénient majeur… Dans un des premiers essais sur l’homme, la présence d’éléments viraux dans le corps d’un patient provoqua une réaction immunitaire létale inattendue.
Avec ce problème en tête, en parallèle de l’amélioration des vecteurs viraux, d’autres généticiens ont mis au point des alternatives : les vecteurs synthétiques.
Les vecteurs synthétiques, késako?! Pas de panique. Cet objet abstrait s’apparente à un mini vaisseau intracorporel construit artificiellement et dont le passager n’est autre que notre ADN réparateur.
A l’heure où je vous parle, une poignée de généticiens utilise ces vecteurs synthétiques pour développer de nouvelles stratégies de traitements afin de lutter contre la myopathie de Duchenne. Ces férus d’ADN testent actuellement ces vaisseaux dernières générations pour tenter d’améliorer la livraison de l’ADN réparateur au sein des cellules musculaires malades.
Suivons les dans leur mission !
Les préparatifs, première étape pour un voyage réussi
Avant toute chose, un bon voyageur se renseigne sur son lieu de destination. Ca tombe bien, le guide du routard vient de sortir un hors série “corps humain”… Ouvrons le chapitre Muscle pour mieux connaître notre destination de livraison.
Au sein des muscles, les vaisseaux sanguins forment un réseau très étendu : chaque cellule musculaire est aisément accessible par voie sanguine. Ainsi, tous les chemins mènent aux muscles! Nos navettes remplies d’ADN ne devraient pas se perdre en route. Par ailleurs, les cellules musculaires présentent des caractéristiques uniques: il existe non pas un, mais une multitude de noyaux à proximité immédiate de la membrane (voir schéma)! Cette organisation cellulaire porte le joli nom de syncytium.
Une fois livré à l’intérieur, l’ADN n’aura donc pas à aller bien loin pour se réfugier dans un noyau!
Cependant, quelques difficultés de parcours sont à prévoir: ce n’est pas si facile de sortir de la circulation sanguine. Les vaisseaux sanguins sont des tuyaux assez peu perméables et le passage vaisseaux-cellule s’avère difficile. Les navettes devront traverser une substance constituée d’un maillage assez serré. Elles auront donc besoin d’un coup de pouce pour sortir de la circulation sanguine et traverser ce maillage pour arriver à proximité immédiate des cellules!
Par ailleurs, en plus de ces obstacles physiques, les molécules d’ADN risquent d’être agressées sur le trajet jusqu’aux noyaux. Et oui, notre organisme dispose d’une multitude de défense pour se protéger des éléments étrangers. Notre action, pourtant bienveillante, sera traitée comme si c’était une agression, ce qui ne facilite pas la mission!
Une stratégie de livraison doit donc être développée, aucun détail ne doit être négligé!

Après avoir décortiqué le terrain, place à la préparation du voyageur. Et on le sait tous, le premier objectif de tout bon voyageur est l’optimisation de la place. Or souvenez-vous, le gène DMD est l’un des plus longs du génome humain, il ne peut donc pas rentrer en totalité dans les navettes. Les généticiens ont alors mis au point un fragment suffisamment court pour qu’il puisse rentrer dans les navettes, mais suffisamment long pour qu’une dystrophine fonctionnelle soit produite sur place. Cette mini version du gène DMD se nomme miniDMD.
Maintenant, ce n’est pas avec un seul miniDMD que l’on va réussir cette mission de thérapie génique. Il en faut des centaines, des milliers, des millions… bref toute une armée de miniDMD pour atteindre un maximum de cellules musculaires malades !
Pour obtenir un gène en énormément d’exemplaires, les généticiens utilisent de véritables usines à production : les bactéries.
Il faut trouver vaisseau à son pied
Avoir une armada de miniDMD c’est bien, de quoi les transporter c’est mieux.
Néanmoins, les généticiens n’ont pas les connaissances précises pour construire ces navettes “super-équipées”. Les spécialistes ici ce sont les chimistes ! Une collaboration étroite entre deux mondes de la science se met alors en place.
« Nous avons besoin d’une navette à deux rôles : transporter l’ADN réparateur jusqu’aux noyaux des cellules musculaires mais aussi le protéger des turbulences et des obstacles qui parsèment le trajet de la circulation sanguine » voilà la demande des généticiens.
Pour répondre à ces critères précis, les chimistes ont plusieurs modèles de navettes en stock dans leur laboratoire.
Le premier qu’ils présentent aux généticiens est un modèle classiquement utilisé pour transférer des gènes quand les cellules sont cultivées in vitro, mais leur efficacité in vivo, c’est à dire à l’intérieur d’un individu vivant, n’est pas assurée !
Modèle Lipoplex : une navette “protectrice” qui encapsule l’ADN réparateur

Les généticiens jettent un coup d’œil sur la notice de fabrication. La structure de cette navette repose sur deux caractéristiques astucieuses :
- Primo, elle est cationique.
“Cationique” ?!!! Ce mot barbare signifie tout simplement : avoir des charges électriques positives.
Cette aptitude est sacrément utile pour bien accrocher le passager dans la navette. L’ADN réparateur qui possède des charges négatives se fixera bien sur les charges négatives de la navette. Les charges négatives de la navette lui permettront aussi de bien se diriger vers la piste d’atterrissage (c’est la membrane plasmique des cellules musculaires qui elle aussi porte des charges négatives).
- Secundo, elle imite les phospholipides (principaux constituants de la membrane plasmique)
Ce premier modèle semble convenir aux généticiens mais en tant que rigoureux scientifique, ils ne se contentent pas d’une seule solution…
Les chimistes leur parlent alors d’un nouveau modèle qui vient d’être créé dans leur laboratoire : grâce à des pièces innovantes assemblées de manières complexes, cette navette dernière génération semble très prometteuse pour mener à bien la mission de transport de l’ADN réparateur aux cellules malade.
Modèle Poloxamer : une navette «guide » qui ouvre la voie à l’ADN réparateur

Un des chimistes explique que ce deuxième modèle est bien différent du premier : contrairement aux modèles des navettes « protectrices », les navettes « guides » ne sont pas cationiques et en fait pas ioniques du tout ! C’est à dire qu’elles ne portent aucune charge électrique, elles sont neutres.
Autre grosse différence : dans le premier modèle, l’ADN est englobé à l’intérieur de la navette alors que dans ce deuxième modèle, l’ADN est simplement posé sur la navette, comme sur une planche à roulette !
A la vue des propositions de ces navettes ultra-performantes, les généticiens décident de commander les deux modèles proposés par les chimistes. Autant mettre toutes les chances de leur côté pour la réussite de la livraison !
La préparation des miniDMD étant achevée, les détails techniques des navettes vérifiés, le voyage tant attendu peut enfin commencer.
L’assemblage des miniDMD avec leur navette est simple : l’ADN s’installe spontanément au sein des vecteurs synthétiques grâce à des interactions ioniques (dans les navettes « protectrices ») et non ioniques (dans les navettes « guides »).
Toujours grâce à ces interactions, l’ADN est très compacté à l’intérieur de ces deux versions de navette : miniDMD, immobilisé, est donc en sécurité pour faire face aux péripéties de ce voyage intracorporel et peut être livré sans dommage à la cellule musculaire en panne.
Voyage au centre de la cellule musculaire
Les navettes Lipoplex et Poloxamer pleins de leurs cargaisons de miniDMD sont maintenant acheminés vers la piste de décollage. Fin prêtes, elles sont placées dans la lance de rampement, la seringue d’injection.
Pour leur faciliter le passage, on les propulse dans les vaisseaux sanguins au niveau des muscles ciblés. En utilisant un garrot, on interrompt momentanément la circulation sanguine dans ce membre, l’isolant ainsi du reste du corps. Puis, en injectant notre solution, l’augmentation du volume dans les vaisseaux va les dilater jusqu’à augmenter leur perméabilité! À ce moment, les navettes passent plus facilement la paroi des vaisseaux sanguins. Cette technique a été cliniquement validée pour une utilisation chez l’homme (), c’est une administration hydrodynamique dans les membres par voie veineuse. (hydrodynamic limb vein injection)
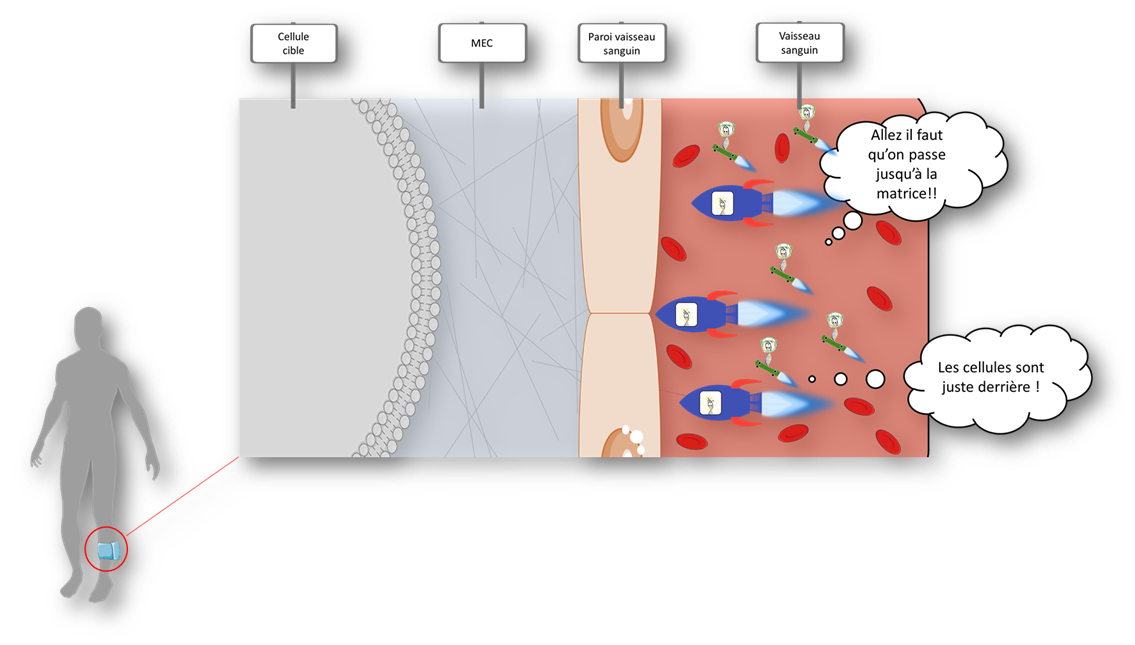
Une fois la paroi du vaisseau sanguin traversée, les vecteurs se heurtent à une nouvelle barrière dite la MEC ! Non pas le Monstre Énorme et Cruel mais la Matrice ExtraCellulaire ; appelée aussi ciment intercellulaire, qui consiste en une sorte de colle qui permet le stockage de l’eau et l’adhésion des cellules dans le tissu.
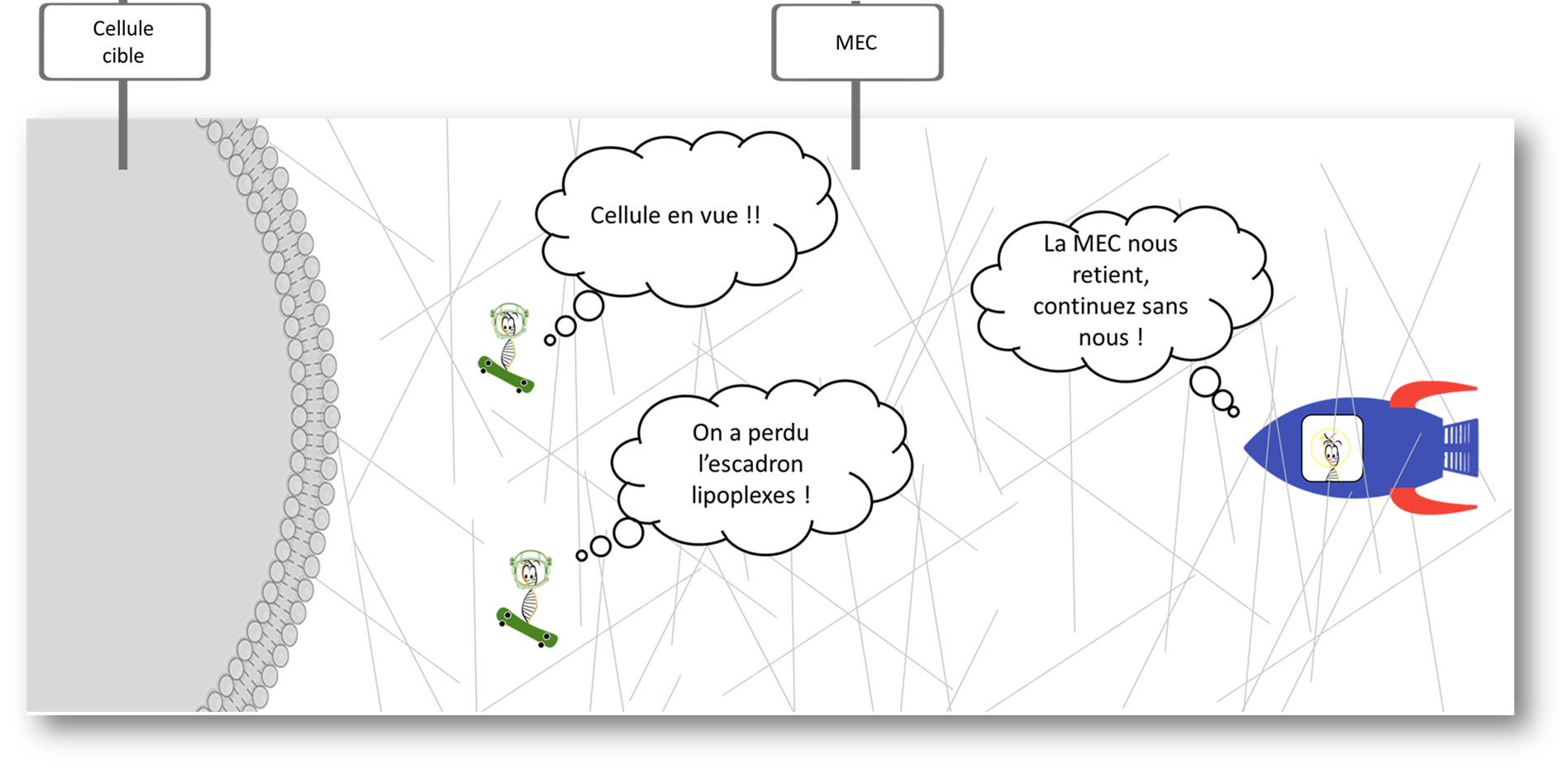
Soudain, un problème se fait sentir… Sur leur lancée, les escadrons Poloxamer n’aperçoivent plus leurs compagnons Lipoplex. Une explication plausible ? à cause de leurs charges positives, les vecteurs Lipoplex sont tombés dans les pièges des charges négatives de la MEC. Malgré cet imprévu, la mission continue qu’avec les Poloxamers, qui étant neutres, ont un “Laissez passer” pour traverser la MEC.
Une fois la MEC traversée, l’escadron Poloxamer commence à s’enfoncer dans la membrane plasmique… petit à petit…… Elle ne se perce pas… Enfin, l’escadron se retrouve encerclé, totalement englobé par la membrane, comme dans une “bulle” flottant dans la cellule. C’est ce que les scientifiques appellent dans leur jargon, l’endosome.
L’endosome n’est pas un endroit hospitalier pour notre escadron, les conditions sont agressives et peu de miniDMD arriveront à s’échapper… Les miniDMDs les plus chanceux ayant réussi à fuir cet endosome commencent à apercevoir l’architecture à l’intérieur de la cellule : le noyau, une boule géante qui renferme des ficelles d’ADN entrelacées, entouré de réticulum endoplasmique, usine de production des protéines, les fibres de microtubules ainsi que les microfilaments, qui relient tout ce qu’il y a à l’intérieur comme des câbles, l’appareil de Golgi, sorte de tour en apesanteur, d’où s’échappent des vésicules, qui ont l’air de danser dans un ballet organisé. Les miniDMD sont fascinés par ce qu’ils voient. C’est l’objectif final de leur grande épopée, et c’est encore plus fascinant que tout ce qu’ils pouvaient imaginer (Vous n’avez jamais vu l’intérieur d’une cellule ? Venez voir par ici!)
Le point final du voyage, transmission d’un message salvateur
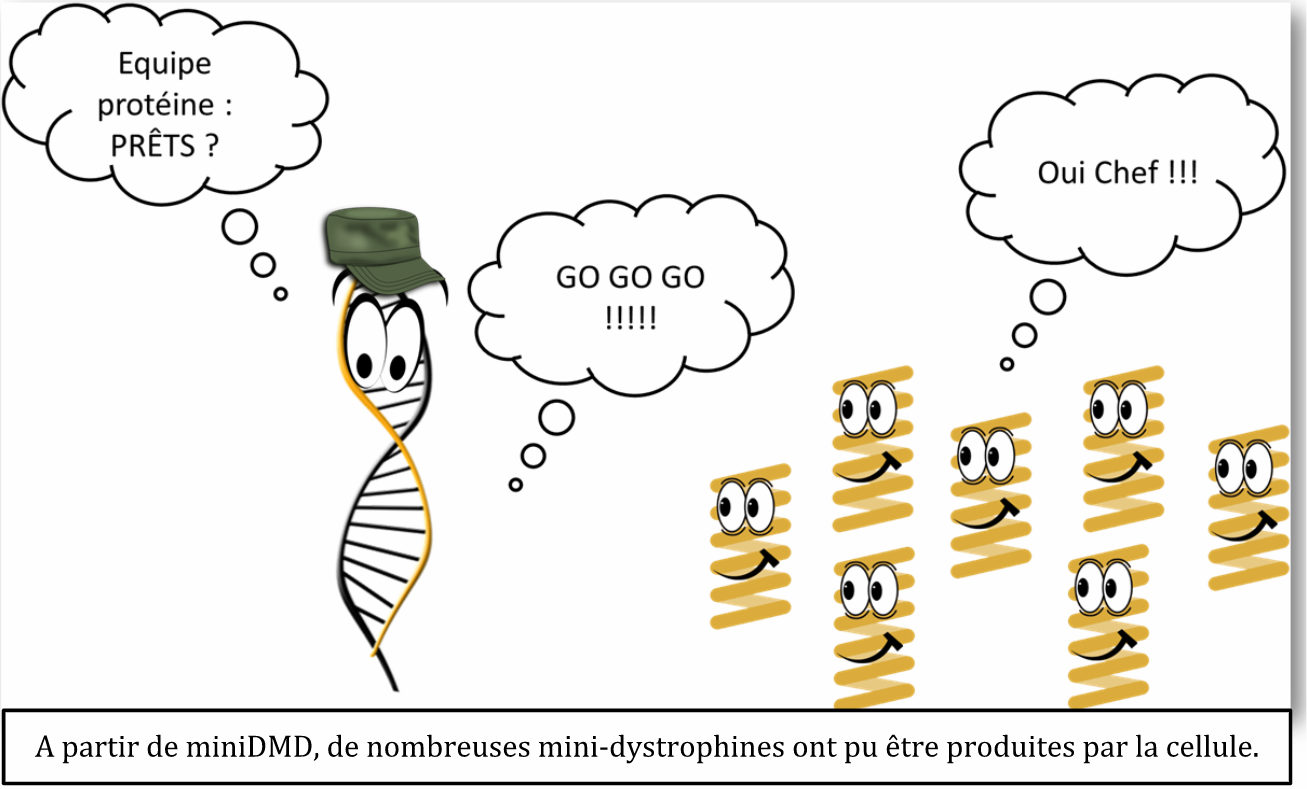
L’objectif stratégique des miniDMDs est réussi ! Malgré quelques turbulences, l’information salvatrice a pu être livrée dans les cellules musculaires malades.
Soudain, c’est le branle bas de combat dans les cellules musculaires. Une coopération entre noyau et cytoplasme s’installe pour prendre en charge les miniDMDs et décoder l’information. Dans ce méli-mélo, les miniDMDs font la rencontre de l’ARN polymérase qui s’occupe de les copier en plein d’ARN messagers : c’est la transcription. Dans la seconde qui suit, ces messagers sont ensuite pris en charge par les ribosomes, ouvriers de la traduction. Grâce à ces deux mécanismes, il aura fallu peu de temps à la cellule musculaire pour décoder l’information portée par miniDMD et produire la protéine tant voulue : la mini-dystrophine.
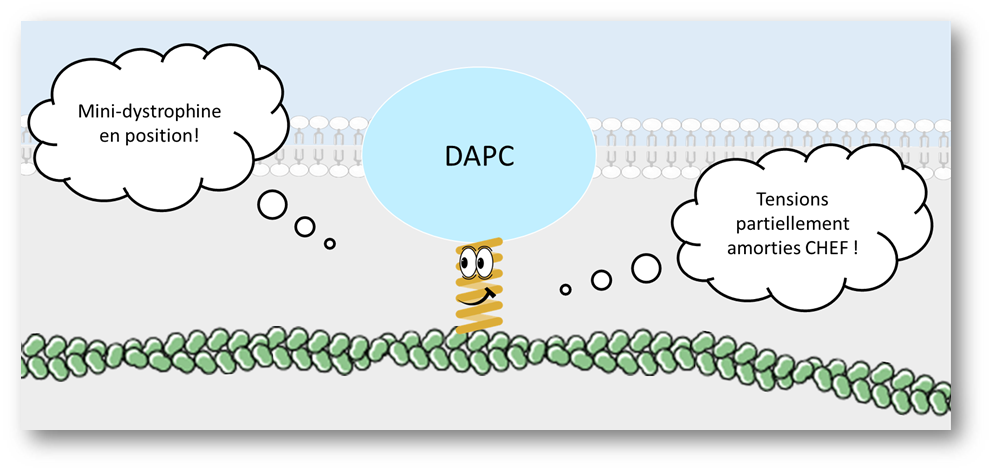
Seulement ce n’est pas fini, une protéine traduite, c’est bien, mais une protéine fonctionnelle et au bon endroit, c’est quand même mieux. À l’intérieur de sa séquence d’acides aminés, la mini-dystrophine possède un signal lui permettant d’être adressée vers la membrane plasmique de la cellule musculaire.
Comme le suggéraient les généticiens, bien que plus courte, la mini-dystrophine commence à assurer sa fonction d’amortisseur en dessous de la membrane. Elle se met en position, les “bras” sur les autres protéines composant le complexe DAPC (Dystrophin Associated Protein Complex) présente dans la membrane et ses “pieds” sur les microfilaments, ossature de la cellule.
Ouste la dégradation : que la répartition des tensions au sein du tissu musculaire commence !!!
Retour à la réalité :
L’odyssée que nous vous avons racontée n’est pas une simple histoire. Cela signe la fin d’un voyage, mais aussi le début d’une potentielle voie thérapeutique. Les vecteurs synthétiques seraient une excellente alternative aux vecteurs viraux pour éviter tous les problèmes de réaction immunitaire.
Cependant, à l’heure actuelle, la livraison de l’ADN par les vecteurs synthétique n’est pas suffisamment performante. Cette solution thérapeutique est encore loin d’être adoptée pour traiter des maladies comme la myopathie de Duchenne mais des chercheurs, comme cette équipe française de Brest, persévèrent à améliorer ces systèmes ! En effet, le trajet que nous avons parcouru est méticuleusement étudié par ces chercheurs. Ils souhaitent identifier et comprendre précisément les obstacles que rencontrent les vecteurs synthétiques sur leur trajet jusqu’au noyau !
Enfin, la mise au point des vecteurs synthétiques ne peut se faire sans les chimistes qui adaptent, progressivement, la nature de ces vecteurs afin de permettre à l’ADN de franchir plus aisément ces obstacles.
© Toutes les images ont été réalisées pour cet article exclusivement.
Bibliographie :
1 – Le complexe DAPC
2 – Une publication qui retrace les techniques thérapeutiques virales pour traiter la myopathie de Duchenne
3 – Une publication de l’équipe de Brest montrant une efficacité de transfection in vivo de Lipoplex dans des poumons de souris
4 – Si vous êtes férus de formules chimiques, un article pour comprendre la formation des Poloxamers
Pour en savoir plus :
→ Des détails génétiques sur le gène de la dystrophine
→ Application des vecteurs synthétiques pour une autre maladie génétique : la mucoviscidose
